ОБЗОР: Таргетная терапия при лечении солидных опухолей: практика противоречит теории
Всего шесть десятилетий отделяют нас от момента первого клинического применения противоопухолевого препарата. За этот период противоопухолевая терапия прошла несколько критических фаз. Любопытно, что почти все основные достижения в цитостатической терапии были достигнуты на ранних этапах ее развития, когда практикующие онкологи имели в своем распоряжении лишь очень небольшой набор противоопухолевых препаратов, а именно цисплатин, доксорубицин, циклофосфамид, 5-фторурацил, тамоксифен и т. Д. .; большинство из них были разработаны 20-30 лет назад. Сегодня при лечении злокачественных новообразований используется огромное количество зарегистрированных цитостатических препаратов, но их количество не трансформировалось в качество, поскольку новые препараты не соответствуют основным целям противоопухолевой терапии - продлению жизни пациента и, идеальный случай, повышение эффективности лечения. Даже если эти цели были реализованы, «выигрыш» от противоопухолевой терапии заключался в небольшом увеличении общей выживаемости (в среднем на 3-5%, реже на 10%). Чаще к «преимуществам» новых лекарств относились такие критерии, как увеличение времени до прогрессирования опухоли, удобство использования лекарств без влияния на процент выживаемости, отсутствие токсических побочных эффектов определенных типов и т. Д. Попытки повысить эффективность лекарств за счет многократного увеличения терапевтическая доза и использование ингибиторов механизмов резистентности опухоли или тканевых протекторов оказались безуспешными. Ситуацию в химиотерапии солидных опухолей накануне XXI века можно охарактеризовать как застойную. К тому времени эффективность «классической» химиотерапии, направленной против генома опухоли и / или аппарата пролиферации клеток, достигла абсолютного потолка. «выигрыш» от противоопухолевой терапии заключался в небольшом увеличении общей выживаемости (в среднем на 3-5%, реже на 10%). Чаще к «преимуществам» новых препаратов относились такие критерии, как увеличение времени до прогрессирования опухоли, удобство использования лекарств без влияния на процент выживаемости, отсутствие токсических побочных эффектов определенных типов и т. Д. Попытки повысить эффективность лекарств за счет многократного увеличения терапевтическая доза и использование ингибиторов механизмов резистентности опухоли или тканевых протекторов оказались безуспешными. Ситуацию в химиотерапии солидных опухолей накануне XXI века можно охарактеризовать как застойную. К тому времени эффективность «классической» химиотерапии, направленной против генома опухоли и / или аппарата пролиферации клеток, достигла абсолютного потолка. «выигрыш» от противоопухолевой терапии заключался в небольшом увеличении общей выживаемости (в среднем на 3-5%, реже на 10%). Чаще к «преимуществам» новых лекарств относились такие критерии, как увеличение времени до прогрессирования опухоли, удобство использования лекарств без влияния на процент выживаемости, отсутствие токсических побочных эффектов определенных типов и т. Д. Попытки повысить эффективность лекарств за счет многократного увеличения терапевтическая доза и использование ингибиторов механизмов резистентности опухоли или тканевых протекторов оказались безуспешными. Ситуацию в химиотерапии солидных опухолей накануне XXI века можно охарактеризовать как застойную. К тому времени эффективность «классической» химиотерапии, направленной против генома опухоли и / или аппарата пролиферации клеток, достигла абсолютного потолка.
К основным нерешенным проблемам современной химиотерапии относятся недостаточная селективность, т.е. неоправданное повреждение нормальных клеток, и эмпирический выбор противоопухолевых препаратов. В силу своей геномной нестабильности опухолевые клетки быстро развивают устойчивость к противоопухолевым агентам; поэтому создание новых цитостатических препаратов со «старым» механизмом действия редко дает положительные результаты. Более того, токсичность лекарства из-за одних и тех же (с опухолью) мишеней в организме пациента (костный мозг, эпителий слизистой оболочки и т. Д.) Ограничивает использование многих цитостатиков в адекватных дозах, что ускоряет развитие лекарственной устойчивости. В отличие от антимикробной терапии, где такие неудачи являются результатом активации новых механизмов резистентности «под давлением» широко используемых антибиотиков, Недавно разработанные цитостатические препараты не смогли повысить эффективность противоопухолевого лечения, поскольку механизмы устойчивости те же, что и 60 лет назад. Это говорит о том, что подход, направленный на повреждение генома опухоли и уничтожение клеток, делает все возможное, и вряд ли можно ожидать прорыва в этой области. Одни и те же мишени для цитостатической терапии как в самой опухоли, так и в нормальных органах и тканях являются основными факторами, ответственными за эти неудачи. Несомненный прогресс достигнут только в терапии опухолей, порог чувствительности которых ниже, чем у нормальных органов и тканей. В других ситуациях все дополнительные подходы, такие как модификация структуры цитостатических препаратов, увеличение дозы с последующей трансплантацией клеток-предшественников гемопоэза, использование ингибиторов механизмов резистентности и т. Д.
Таргетная терапия - это принципиально новый подход к медикаментозному лечению злокачественных новообразований, появившийся в последнее десятилетие. Хотя ее цель еще не сформулирована окончательно, подразумевается, что ее основное отличие от традиционной химиотерапии заключается в целенаправленном воздействии на опухолевые клетки, не нарушая нормальных клеток и тканей. Ожидалось, что новый подход, независимо или в сочетании с традиционной химиотерапией, станет радикальным отходом от «классических» методов и прорывом в фармакотерапии злокачественных опухолей. Учитывая, что основные принципы таргетной терапии были заявлены около десяти лет назад, нам кажется целесообразным рассмотреть ее основные вехи и подвести некоторые промежуточные результаты в их практическом применении.
ОПРЕДЕЛЕНИЕ НАПРАВЛЕННОЙ ТЕРАПИИ
Какова цель таргетной терапии и что мы называем лекарствами таргетного действия? Не существует четких описаний, отличающих таргетную терапию от других подходов к противоопухолевой терапии. Первое официальное заявление об основных целях, сделанное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), предполагает, что под лекарственным средством целевого действия следует понимать лекарство, рецепту которого должен предшествовать официально зарегистрированный диагностический тест, подтверждающий существование целевого препарата за его эффект. Требуется, чтобы этот диагностический тест был неотъемлемой частью неявной комбинации, компонентом которой является лекарство целевого действия, и, хотя и поставляется под разными покрытиями, всегда должен использоваться как единое целое, чтобы обеспечить максимальный терапевтический эффект. эффект [ 1]. Хотя это определение дает исчерпывающее описание одного из основных принципов таргетной терапии, то есть идентификации цели до ее назначения пациенту (или, точнее, пациентам, опухоли которых выражают эту цель), мы не думаем, что это быть полным. Присутствие ДНК, основной мишени для алкилирования цитостатических агентов, в любой опухолевой клетке может быть легко установлено с помощью зарегистрированных диагностических тестов, но это не причина для отнесения, например, циклофосфамида к лекарствам таргетного действия. На наш взгляд, основные требования к таргетной терапии следующие:
- подтвержденное влияние на мишень (рецептор, фактор роста и т. д.), критическое для выживания опухоли и не наносящее ущерба нормальным органам и тканям;
- проверка и оценка цели (целей) зарегистрированными диагностическими тестами; прогнозирование эффективности противоопухолевой терапии (например, высокая эффективность при наличии цели и нулевая эффективность при ее отсутствии);
- отсутствие токсичности, связанной с основным механизмом действия препарата, и низкий или нулевой уровень неспецифической токсичности (аллергические реакции, эффекты коагуляции и др.).
Использование этого набора критериев помогает преодолеть главный недостаток традиционной химиотерапии - эмпирическое назначение лекарств (одна и та же химиотерапия обычно назначается всем пациентам с определенным типом и стадией опухоли без предварительного разделения их на когорты с наиболее благоприятным прогнозом). терапевтический эффект) и их неспецифическое действие (применение препаратов в максимально эффективных дозах часто ограничивается их общетоксичностью).
В настоящее время огромное количество противоопухолевых агентов, «заявленных» производителями как препараты целевого действия и «допущенных» для использования практикующими врачами в этой области, прошли регистрацию и / или проходят клинические испытания. Наиболее популярные из них:
- препараты, действующие на рецепторы (и их лиганды), ферменты и т. д., опосредующие передачу сигнала к опухолевым клеткам (антитела, небольшие молекулы и т. д.);
- препараты, ингибирующие микросреду опухоли, критически важную для выживания опухоли;
- антитела, вызывающие иммунный ответ и / или доставляющие токсичные вещества (радиоактивные материалы, цитостатические препараты и т. д.) к опухолевым клеткам.
Большинство этих агентов лишены цитотоксической активности и способности убивать или повреждать опухолевые клетки, но обладают выраженным цитостатическим действием, ингибируя пролиферацию и / или стимулируя дифференцировку опухолевых клеток посредством ингибирования механизмов, ответственных за формирование злокачественного фенотипа. Другими словами, эффекты этих препаратов не являются лечебными и заключаются в замедлении роста опухоли или, в лучшем случае, в уменьшении массы опухоли, что не умаляет их достоинств, при этом происходит переход от злокачественного новообразования к вялому хроническому процессу. только цель несколько менее привлекательная, чем лечение.
В этом обзоре современное состояние таргетной терапии солидных опухолей будет рассмотрено на примере некоторых из наиболее популярных препаратов таргетного действия - моноклональных антител (бевацизумаб и трастузумаб) и ингибиторов тирозинкиназы (эрлотиниб и др.). гефитиниб).
АНТИАНГИОГЕННАЯ ТЕРАПИЯ И БЕВАЦИЗУМАБ
Воздействие на VEGF (вазоэндотелиальный фактор роста) имеет решающее значение для выживания опухоли и не наносит ущерба нормальным органам и тканям. В нормальных условиях активация ангиогенеза, то есть образование новой сосудистой сети, происходит во время эмбриогенеза или, если мы имеем дело со взрослыми организмами, в определенных физиологических состояниях, например, беременность, заживление ран и т. Д. У здоровых взрослых только 0,01% эндотелиальных клеток проходят митоз (1 раз в 10 лет) [ 2]. Однако ситуация кардинально меняется, если включить онкогенез. Конечно, ни онкогенез, ни постоянная потребность опухолей в кислороде и питательных веществах не «программируются» организмом заранее. В момент возникновения злокачественные опухоли окружены кровеносными сосудами, снабжающими нормальные ткани кислородом и питательными веществами; следовательно, полезные вещества могут быть доставлены к опухолевым клеткам только путем диффузии и только при небольших размерах опухоли (1-2 мм 3 ) [ 3]. Первоначально опухоль лишена стромы, клетки которой (фибробласты и др.) Способны продуцировать специальные проангиогенные вещества, инициирующие рост новых сосудов в постэмбриональный период. Следовательно, на ранних этапах туморогенеза опухолевые клетки должны восстановить эту способность, характерную для их эмбриональной стадии. Именно это обстоятельство, а не усиление пролиферации опухолевых клеток увеличивает временной интервал до момента, когда масса опухоли достигнет определенного «клинически значимого» уровня. Из-за неоднородности популяций опухолевых клеток проангиогенные вещества могут продуцироваться только первичными (но не метастатическими) опухолями.
Гипоксия из-за продолжающегося недостаточного кровоснабжения является основным фактором, стимулирующим ангиогенез опухоли. Способность стимулировать ангиогенез характерна для многих активных веществ: VEGF; фактор роста тромбоцитов (PDGF или тимидинфосфорилаза); фактор роста фибробластов (FGF-1, FGF-2); ангиопоэтин-1 (ang-1) и др. Они продуцируются опухолевыми, стромальными и эндотелиальными клетками, внеклеточным матриксом и клетками крови [ 4]. В нормальных условиях и при росте опухоли активность проангиогенных веществ уравновешивается антиангиогенными веществами. Относительный вклад проангиогенных и антиангиогенных молекул в формирование сосудистой сети опухоли зависит от гистологического типа и происхождения опухоли, динамики их экспрессии в онкогенезе, а также от регрессии и рецидива опухоли. Их влияние на формирование новой сосудистой сети опухоли реализуется через различные механизмы, такие как повышение проницаемости сосудистой стенки, привлечение циркулирующих предшественников эндотелиоцитов, стимуляция миграции и пролиферации эндотелиоцитов и т. Д.
У взрослых организмов процессы васкуляризации инициируются циркулирующими предшественниками эндотелия (CEP) и гемопоэтическими стволовыми клетками (HSC) (возможно, происходящими из общего предшественника (гемангиобласта)), происходящими из костного мозга. Эти клетки экспрессируют на своей поверхности специальные рецепторы для основного фактора, способствующего ангиогенезу, VEGF [ 5 ]. Именно CEP и HSC, а не зрелые эндотелиоциты, ответственны за начало ангиогенеза опухоли [ 6 ]. Способность этих клеток, находящихся в костном мозге и периферической крови, стимулировать ангиогенез у взрослых организмов, является предпосылкой для положительного эффекта «аутотрансплантации» костного мозга (или стимулированных HSC) у пациентов с ишемической болезнью сердца.
Ангиогенез опухоли никогда не происходит «в нужном месте и в нужное время», а новообразованные сосуды обычно имеют недостаточность как по структуре, так и по функциям. Образование «незрелых» сосудов с нарушенной структурой стенки и неправильной архитектоникой является результатом дисбаланса между проангиогенным и антиангиогенным эффектами на ангиогенез опухоли. Эти дефекты компенсируются повышенной проницаемостью и высокой плотностью микрососудов опухоли. Некоторые типы опухолей (например, рак молочной железы и толстой кишки, меланомы и т. Д.) Проявляют сосудистую мимикрию или мозаичную структуру, где некоторые части их микрососудистой стенки состоят из опухолевых клеток, а не из эндотелиальных клеток [ 7 , 8 ]. Благодаря такой мозаичной структуре ежедневно до 10 6опухолевые клетки (вся масса опухоли обычно не превышает 1 г) выходят в циркулирующую кровь [ 8 ]. Эти факторы прямо или косвенно увеличивают злокачественный потенциал опухоли и снижают ее чувствительность к противоопухолевой терапии. Повышенная проницаемость и высокая плотность микрососудов опухоли, а также сосудистая мимикрия обеспечивают адекватное снабжение тканей опухоли питательными веществами и стимулируют метастазирование, несмотря на незрелость сосудов, в то время как нарушение архитектоники и структурная недостаточность сосудов опухоли создают высокий градиент давления, который препятствует циркуляции и доставке лекарств в опухолевые клетки.
Эти события делают ангиогенез и образованную de novo сосудистую сеть опухоли привлекательными мишенями для противоопухолевой терапии. Соединения, стимулирующие рост новых сосудов и функциональную активность их специфических рецепторов, и сформированный de novo эндотелий сосудов являются потенциальными мишенями для антиангиогенной терапии.
Как следует из определения, антиангиогенная терапия не является лечебной, не направлена на опухолевые клетки. Однако ингибирование ангиогенеза опухоли и регрессия опухолевых сосудов, сформированных de novo, может переводить опухоль в «спящее» состояние, связанное с задержкой роста опухоли и уменьшением ее размера из-за гипоксии. В идеале опухоль и метастазы должны стать клинически не обнаруживаемыми, поскольку питательные вещества могут проникать в них исключительно путем диффузии. Подавление ангиогенеза может привести к «нормализации» внутриопухолевой сосудистой сети [ 9]. Этот феномен используется многими авторами как пример парадоксального синергизма в действии обычных цитостатических и антиангиогенных препаратов, т.е. «деваскуляризация» теоретически должна быть связана с подавлением доставки цитостатических препаратов к клеткам-мишеням, но «нормализация» сосудистой сети опухоли улучшает лекарство. доставка даже при уменьшении количества судов.
Наиболее популярные цитостатические препараты (таксаны, ингибиторы топоизомеразы, пуриновые антиметаболиты, интерферон и др.) Обладают токсическим (прямым и косвенным) действием на сосудистую сеть опухоли. Это обстоятельство стимулировало развитие нового направления в лечении рака - метрономной химиотерапии. Это влечет за собой назначение цитостатических препаратов в гораздо более низких дозах, чем это необходимо для получения «прямого» противоопухолевого эффекта, но достаточно высоких, чтобы разрушить эндотелий сосудов опухоли. Эти дозы обычно нетоксичны; следовательно, цитостатические препараты можно вводить в течение достаточно длительного периода времени без риска восстановления поврежденного эндотелия [ 10]. Предполагается, что использование эндотелиальных клеток в качестве мишеней для противоопухолевой терапии позволит избежать или значительно отсрочить возникновение резистентности, поскольку в отличие от опухолевых клеток геном эндотелиальных клеток менее подвержен мутациям. Предварительные исследования солидных опухолей дали обнадеживающие результаты, но не вышли за рамки протокола пилотного исследования [ 11 , 12]. Следует признать, что некоторые подходы, разработанные задолго до появления метрономной терапии, имеют схожие антиангиогенные механизмы действия. Примером может служить использование поддерживающей терапии у пациентов с острым лимфобластным лейкозом. У этих пациентов интенсивная индукционная терапия и консолидация ремиссии поддерживались длительным приемом низких доз цитостатических препаратов, что уменьшало риск рецидива. Хотя эта терапия получила широкое признание, ее вклад в общий терапевтический эффект довольно невелик и не может рассматриваться как полноценная таргетная терапия, поскольку она не направлена против конкретных целей.
VEGF - один из самых мощных стимуляторов неоангиогенеза. Этот пептид или, точнее, один из представителей семейства VEGF, VEGF-A, был выделен и описан в 1980-х годах под названием «фактор сосудистой проницаемости» (VPF) [ 13], что отражает его способность увеличивать проницаемость сосудов с ~ 1000 раз большей эффективностью, чем гистамин. В настоящее время известно несколько изоформ белка VEGF (VEGF-A - VEGF-E), фактора роста плаценты (PLGF) и близких по структуре гликопротеинов (PDGF). Повышенная экспрессия изоформ VEGF характерна для некоторых злокачественных опухолей (груди, легких, поджелудочной железы, почек, яичников, мочевого пузыря, головного мозга; множественные миеломы, лимфомы и др.); очень часто это предсказывает неблагоприятный исход. Гипоксия - главный фактор, стимулирующий синтез VEGF, особенно в паранекротических зонах опухоли. Синтез VEGF в условиях гипоксии является результатом повышенной экспрессии фактора, индуцированного гипоксией (HIF-1). Продукт гена опухолевого супрессора фон Хиппеля-Линдау (VHL) отвечает за негативную регуляцию VEGF [ 14]. Низкая активность этого гена связана с наследственным синдромом, проявляющимся в активации неоангиогенеза и высоким риском злокачественных новообразований (почки, мозг, надпочечники, поджелудочная железа и др.).
Эффект VEGF направлен на домены, прилегающие к сайту его синтеза, но он также может влиять на более отдаленные цели. VEGF оказывает свое действие на эндотелиальные клетки посредством связывания с их специфическими рецепторами. Различные представители семейства VEGF (VEGF-A, -B, -C, -D и PLGF) с разной аффинностью связываются с тремя основными рецепторами тирозинкиназы - VEGFR-1 (fms-подобная тирозинкиназа-1, Flt-1) , VEGFR-2 (KDR; Flk-1) и VEGFR-3. Действие наиболее активного изомера (VEGF-A) на эндотелиальные клетки опосредуется VEGFR-1 и VEGFR-2; VEGFR-3 отвечает за формирование и функционирование лимфатических сосудов [ 15 ].
Эти данные позволяют предположить, что VEGF является привлекательной мишенью для противоопухолевой терапии, поскольку позволяет реализовать все основные цели антиангиогенной терапии. В современных исследованиях активность VEGF «нейтрализуется» специфическими гуманизированными антителами, например бевацизумабом (Авастином). Их связывание с VEGF блокирует его способность действовать на специфические рецепторы.
Клинические рандомизированные исследования установили, что комбинация бевацизумаба с химиотерапией (иринотекан плюс 5-фторурацил) значительно (с 15,6 до 20,3 месяцев) увеличивает среднюю выживаемость у пациентов с метастатическим колоректальным раком, ранее не получавших цитостатической терапии [ 16 ]. У пациентов с колоректальным раком, прогрессировавшим после химиотерапии иринотеканом, добавление бевацизумаба к терапии второй линии (оксалиплатин плюс 5-фторурацил) значительно увеличивало выживаемость по сравнению с контрольной группой (только химиотерапия по той же схеме) с 10,8 до 13 месяцев [ 17 ]. В этом исследовании отбор пациентов для монотерапии бевацизумабом (третья группа исследования) пришлось прекратить из-за худших показателей выживаемости.
Терапевтическая эффективность паклитаксела, вводимого в виде монотерапии или в комбинации с бевацизумабом, изучалась у пациентов с метастатическим раком молочной железы, ранее не получавшим химиотерапию. Статистически значимое ( p <0,0001) улучшение выживаемости без прогрессирования было обнаружено в когорте, получавшей комбинированную терапию (медиана выживаемости составила 13,3 месяца по сравнению с 6,7 месяцами у пациентов, получавших монотерапию паклитакселом). Однако продолжительность жизни (общая выживаемость) в группе, получавшей комбинированную терапию, не увеличилась [ 18 ]. В другом протоколе добавление бевацизумаба к химиотерапии (капецитабин) не привело к улучшению терапевтического эффекта у пациентов с метастатическим раком молочной железы, ранее получавшим химиотерапию [ 19]. На основании этого открытия бевацизумаб не рекомендовался для включения во вторую и последующие линии лечения метастатического рака молочной железы.
У пациентов с метастатическим немелкоклеточным раком легкого (НМРЛ) бевацизумаб в сочетании с химиотерапией (карбоплатин плюс паклитаксел) вызывал статистически значимое увеличение общей выживаемости до 12,3 месяцев по сравнению с 10,3 месяцами у пациентов, получавших только химиотерапию (контроль) [ 20 ].
Эти данные предполагают, что комбинированное лечение (бевацизумаб плюс химиотерапия) является стратегией выбора у пациентов с раком груди, НМРЛ и колоректальными опухолями. Однако монотерапия бевацизумабом оказалась наименее эффективной у этой категории пациентов. Рак яичников - единственная опухоль, терапевтический эффект бевацизумаба соизмерим с действием обычных лекарств. Однако показание таким пациентам бевацизумаба всегда влечет за собой высокий риск летальных осложнений, например перфорации кишечника и перитонита [ 21 , 22 ].
Наличие VEGF может быть доказано и определено с помощью зарегистрированных диагностических тестов и имеет прогностическое значение для терапии. В зависимости от размера любой клинически обнаруживаемой опухоли для роста требуется новая сосудистая сеть. Этот процесс широко известен как ангиогенез, опосредованный VEGF. Однако клинические эффекты антиангиогенных препаратов наблюдаются у определенных категорий пациентов, т.е., несмотря на априорную универсальность, терапия против VEGF эффективна против ограниченного круга злокачественных опухолей.
Попытки установить пороговый уровень экспрессии VEGF (проангиогенных веществ или их специфических рецепторов), выше которого терапевтический эффект от бевацизумаба наиболее вероятен, не увенчались успехом. Цели для этих анализов (кровь, ткани, эндотелиальные или опухолевые клетки) и методы их анализа также были неясны. В отличие от экспериментальных моделей, используемых для изучения эффектов бевацизумаба на ангиогенез в повторно инокулированных опухолях, локализованных в удобном для исследователя месте (например, подкожно-жировая клетчатка, брюшная полость и т. Д.), Клинические исследования антиангиогенных препаратов должны проводиться в различных микро средах в зависимости от первичной и метастатической локализации опухоли (легкое, печень, кости, мозг, метастазы и др.). Следовательно, результат антиангиогенной терапии зависит от многих факторов, таких как конкретная локализация,
Как упоминалось выше, эффекты VEGF опосредуются двумя рецепторами, VEGFR-1 и VEGFR-2. Даже в эндотелиоцитах и их предшественниках эти рецепторы выполняют различные функции, которые не являются однозначными с точки зрения противоопухолевого лечения. У взрослых VEGFR-1 и VEGFR-2 экспрессируются практически всеми эндотелиальными клетками сосудов (за исключением кровеносных сосудов головного мозга). Эффекты VEGFR-2 на эндотелий сосудов были подробно изучены и заключаются в стимуляции ангиогенеза за счет пролиферации, миграции и дифференцировки эндотелиальных клеток и ингибирования их апоптоза. Кроме того, этот рецептор отвечает за повышенную проницаемость сосудов и образование сосудистых островков [ 23]. Функциональная роль VEGFR-1 значительно менее понятна и более неопределенно описана как зависящая от стадии развития и типа клеток [ 24]. Роль циркулирующих (не связанных с клетками) рецепторов VEGF еще полностью не изучена; предположительно, они действуют как ловушки VEGF в большом круге кровообращения. Экспрессия рецепторов VEGF и, соответственно, их предполагаемая роль не ограничивается эндотелиоцитами. Экспрессия VEGFR-1 была обнаружена в других (включая неэндотелиальные) клетках, таких как HSC, моноциты, трофобласты, хориокарциномы, множественные миеломы и лейкозные клетки. VEGFR-2 экспрессируется в CEP, эпителиальных клетках поджелудочной железы, предшественниках сетчатки, мегакариоцитах и т. Д. Коэкспрессия VEGFR-1 и VEGFR-2 происходит в интактных клетках яичек и миометрия. Высокие уровни обоих рецепторов (ко-гиперэкспрессия) характерны для опухолей почек, мочевого пузыря, яичников, груди и некоторых опухолей головного мозга.
В 2003 году мы выявили экспрессию рецепторов VEGF на опухолевых клетках рака молочной железы и впервые показали, что разные рецепторы имеют противоположно направленное прогностическое значение [ 25 ]. У пациентов с местно-распространенным раком молочной железы экспрессия VEGFR-1 после прекращения неоадъювантной химиотерапии предсказывает значительное увеличение выживаемости, тогда как экспрессия VEGFR-2 подразумевает значительное ухудшение прогноза. Функциональная роль этих рецепторов в опухолевых клетках до сих пор неясна, но результаты этого исследования заслуживают внимания и подтверждаются с помощью более совершенных методов, чем те, которые использовались в нашем исследовании [ 26 - 29]. Мы исходили из предположения, что VEGF, секретируемый опухолевыми клетками в условиях гипоксии, может ингибировать их пролиферацию, воздействуя на опухолевые клетки, экспрессирующие VEGFR-1. Подобные эффекты на опухолевые клетки, экспрессирующие VEGFR-2, вызывают метастазирование, поскольку все эти механизмы, будь то ингибирование роста или метастазирование, позволяют опухолевым клеткам выходить из гипоксии различными путями. Было высказано предположение, что эффекты VEGF на опухоль могут реализовываться не только через проангиогенные факторы, но также могут быть прямыми, то есть стимуляцией или ингибированием. Эта гипотеза не получила широкого признания во время ее формулировки в 2003 году, поскольку в то время антиангиогенные препараты были недоступны. Экспериментальная проверка этой гипотезы позволит выделить популяцию пациентов с опухолевыми клетками, экспрессирующими VEGFR-1, которым противопоказана антиангиогенная терапия, основанная на ингибировании VEGF. В противном случае у пациентов со сверхэкспрессией VEGFR-2 в опухолевых клетках нейтрализация VEGF, основанная на «прямом» ингибировании пролиферации и метастазирования, может вызвать дополнительный противоопухолевый эффект.
Отсутствие токсичности, связанной с основным механизмом действия бевацизумаба, и низкий или нулевой уровень неспецифической токсичности. Как и ожидалось, бевацизумаб лишен вредных побочных эффектов (цитопения, стоматит и т. Д.), Характерных для других цитостатиков, но несколько увеличивает риск миелосупрессии при использовании в сочетании с химиотерапией (по-видимому, из-за его влияния на HSC). Однако этот препарат имеет ряд побочных эффектов, некоторые из которых могут быть очень серьезными. (Эти эффекты подробно описаны в инструкции по применению препарата в США, где обобщены данные (как опубликованные, так и неопубликованные) цитируемых исследований [ 17 - 22].]). У пациентов с колоректальным раком у 2,4% пациентов, получавших бевацизумаб, была перфорация кишечника с летальным исходом примерно в 30%. Несмотря на высокую клиническую эффективность схемы бевацизумаб плюс химиотерапия у пациентов с раком яичников, от этого лечения пришлось отказаться из-за высокой частоты перфораций кишечника. У 4-15% пациентов, перенесших экстренные операции на фоне лечения бевацизумабом, заживление ран осложнилось расхождением внешних и внутренних швов, недостаточностью анастомозов, раневыми кровоизлияниями и т. Д.
Тридцать один процент пациентов с плоскоклеточным раком и 4% пациентов с другими гистологическими подтипами немелкоклеточного рака легкого, получавших комбинированное лечение (бевацизумаб плюс химиотерапия), имели тяжелые или смертельные кровотечения. Примечательно, что в когорте, получавшей только химиотерапию, такие осложнения отсутствовали. Для этой группы также были характерны артериальные тромбозы и тромбоэмболии (инсульты, преходящая ишемия, инфаркт миокарда, окклюзия легочной артерии и др.), Иногда со смертельным исходом. Эти осложнения были обнаружены у 4,4% пациентов, получавших бевацизумаб в сочетании с химиотерапией (для сравнения: 1,9% в группе химиотерапии). Тяжелая (III и IV степени) артериальная гипертензия в группе лечения бевацизумабом встречалась чаще (8–18%). У <= 3% пациентов бевацизумаб вызывал выраженную протеинурию (> 3. 5 г белка в сутки); нефротический синдром был обнаружен у 0,5% пациентов, получавших бевацизумаб. Примечательно, что у пациентов этой группы уровень белка в моче никогда не возвращался к норме после прекращения терапии бевацизумабом.
АНТИ-HER-2-ТЕРАПИЯ И ТРАСТУЗУМАБ
Влияние на HER-2 критично для выживания опухоли и не наносит ущерба нормальным тканям и органам. HER-2 (HER-2 / neu или ErbB2) представляет собой трансмембранный рецептор тирозинкиназы, относящийся к семейству рецепторов эпидермального фактора роста (EGFR). Помимо HER-2, это семейство включает другие рецепторы - EGFR (ErbB1), ErbB3 и ErbB4. Функциональная роль этих рецепторов, которые выражаются подавляющим большинством нормальных и злокачественно трансформированных эпителиальных клеток, заключается в передаче трансмембранных сигналов. Однако предполагается, что злокачественные клетки, активность которых стимулируется этим путем, проявляют качественные (мутации, структурные изменения и т. Д.) Или количественные (сверхэкспрессия, амплификация) преобразования рецепторов и / или их кодирующих генов. Все рецепторы EGFR имеют сходную структурную организацию и состоят из внеклеточного домена, ответственного за связывание лиганда,30 ].
Взаимодействие лигандов EGFR, ErbB3 и ErbB4 с внеклеточным доменом приводит к гетеро- или гомодимеризации соответствующих рецепторов, то есть связыванию двух разных или идентичных рецепторов. Отличительной особенностью рецепторов EGF является димеризация и последующее фосфорилирование фрагмента тирозинкиназы и активация внутриклеточных каскадов, ответственных за запуск и передачу внутриклеточных сигналов. Роль лигандов выполняют многочисленные связанные с EGF пептиды - эпидермальный фактор роста (EGF), амфирегулин, бетацеллулин, эпирегулин и др. Большинство лигандов рецептора ErbB высвобождаются и действуют локально (в аутокринном или паракринном режиме) [ 31 ] .
HER-2 не имеет собственных лигандов; его гипотетическая функция - «партнерство» при гетеродимеризации с другими членами этого семейства [ 32]. Способность к гетеродимеризации - необходимое условие эффективного функционирования «дефектных» членов семьи. Таким образом, гетеродимеризация HER-2, лишенного лиганда, и ErbB3, лишенного активной тирозинкиназы, создает «пару», которая эффективно передает внешние сигналы внутри клетки. Гетеродимеризация также влияет на «амплитуду» и продолжительность передачи сигнала после связывания лиганда. Гетеродимеры, содержащие HER-2, обладают более сильным и продолжительным действием благодаря способности HER-2 усиливать связывание рецептора-партнера с лигандом, подавлять интернализацию комплекса лиганд-рецептор и увеличивать вероятность повторного использования рецепторов, которые были интернализованы [ 33 ].
Фосфорилирование тирозинкиназы приводит к активации сигнальных путей, запускающих такие важные для процессов прогрессирования опухоли, как рост, пролиферацию, миграцию, дифференцировку и ингибирование апоптоза клеток. Помимо передачи сигнала, эти взаимодействия могут вызывать усиление или разделение сигналов путем изменения клеточных ответов на одни и те же стимулы [ 30 ].
Считается, что количественные или качественные изменения специфических рецепторов (или кодирующих генов) некоторых представителей семейства ErbB ответственны за образование и рост многих злокачественных эпителиальных опухолей (груди, толстой кишки, поджелудочной железы, легких, мочевого пузыря, почки и т. Д.) ). Их наличие во многих опухолях связано с неблагоприятным прогнозом и низкой эффективностью противоопухолевой терапии [ 31]. Гиперэкспрессия HER-2 и / или амплификация гена, кодирующего HER-2 (HER-2-положительные опухоли), обнаруженные у 25-30% пациентов с раком груди, связаны (точнее, были связаны до начала клиническое применение трастузумаба) со значительным снижением выживаемости по сравнению с популяцией пациентов, аналогичной первому по другим характеристикам. Неблагоприятный отдаленный клинический прогноз для таких пациентов можно объяснить как более высокой агрессивностью HER-2-положительных опухолей, так и их меньшей чувствительностью к химиотерапии и эндокринной терапии [ 34 , 35]. Эти клинические данные стимулировали разработку широкого спектра агентов, ингибирующих ErbB. Любопытно, что целенаправленное воздействие на внеклеточный домен HER-2, лишенный активирующего лиганда, дало наиболее клинически значимые результаты.
Трастузумаб (Герцептин) включает гуманизированные моноклональные антитела к внеклеточному домену рецептора HER-2. Благодаря его внедрению в клиническую практику ряд пациентов с опухолями молочной железы, обладающими сверхэкспрессией HER-2 и / или амплификацией гена, кодирующего HER-2, получили реальный шанс на продление жизни при метастатическом раке или дополнительный шанс на излечение. на ранних стадиях болезни. Кроме того, применение анти-HER-2-терапии впервые в онкологической практике изменило вектор прогностической значимости маркера: выживаемость пациентов с HER-2-положительными опухолями (ранее считавшимися наиболее неблагоприятными). в настоящее время превосходит пациентов с HER-2-отрицательными опухолями [ 36]. В то время как медиана общей выживаемости у пациентов с метастатическим раком молочной железы увеличилась с 438 дней в 1991–1992 годах до 667 дней в 1999–2000 годах (т.е. в течение десятилетия «прирост» составил 229 дней (7,6 месяцев), несмотря на доступность многих цитостатических препаратов) [ 37 ], только добавление трастузумаба к химиотерапии с таксанами увеличивало этот показатель у HER-2-положительных пациентов на 7-9 месяцев!
Механизм противоопухолевого действия трастузумаба до сих пор недостаточно изучен. Попытки приписать этот эффект к повышению интернализации и деградации HER-2 не удалось, в то время как многочисленные клинические исследования показали , что уровень экспрессии рецепторов не изменялись в течение трастузумаба терапии (даже с четкой клинической пользы) [ 38 - 40 ]. Хотя доклинические исследования in vivo показали, что противоопухолевый эффект трастузумаба может быть частично связан с индуцированной трастузумабом антителозависимой цитотоксичностью [ 41 , 42]], причина отсутствия противоопухолевого действия трастузумаба на другие опухоли с избыточной экспрессией HER-2 с помощью универсальных иммунных механизмов неясна. Ничего не известно о способности трастузумаба подавлять активность HER-2 при образовании функционально активных гетеродимеров. Более или менее однозначным является тот факт, что эффекты трастузумаба реализуются за счет его взаимодействия с внеклеточным доменом HER-2. Было обнаружено, что ErbB-2 может иметь укороченную форму, лишенную внеклеточного домена (p95ErbB2), причем экспрессия этой формы сопровождается устойчивостью к трастузумабу как в экспериментальных, так и в клинических исследованиях. В то же время, по некоторым данным, эта изоформа рецептора содержит функционально активную тирозинкиназу, способную функционировать независимо от наличия внеклеточного домена [ 43]. Доклинические исследования показали, что трастузумаб обладает скорее цитостатическим, чем цитотоксическим действием. После прекращения действия трастузумаба на опухолевые клетки они возобновляют свою пролиферацию [ 44 ].
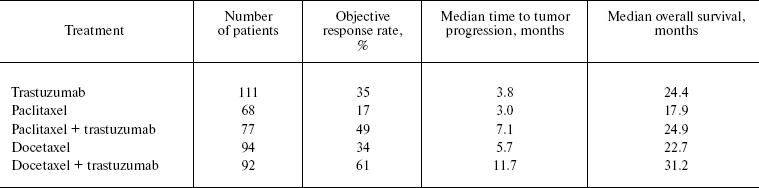
Первоначально трастузумаб использовался для лечения пациентов с метастатическим раком груди. У пациентов с гиперэкспрессией HER-2 (иммуногистохимический индекс 2 + / 3 +) эффективность трастузумаба оценивалась как 15% (пациенты, получавшие ранее лечение) [ 45 ] и 35% у пациентов, ранее не получавших химиотерапию [ 46 ]. Добавление трастузумаба к цитотоксической химиотерапии улучшило как объективную скорость ответа опухоли, так и выживаемость пациентов (таблица 1 ) [ 47 , 48 ].
Таблица 1. Эффективность трастузумаба в качестве терапии первой линии у пациентов с метастатическим раком груди и сверхэкспрессией HER-2 [ 46 - 48 ]
Неожиданно у пациентов с операбельным раком молочной железы с гиперэкспрессией HER-2 выигрыш от трастузумаба в сочетании с адъювантной терапией был достигнут необычно быстро. Рандомизированные исследования (с общим числом пациентов> 13000) даже при очень коротком наблюдении (период наблюдения 2-3 года) показали, что трастузумаб, добавленный к адъювантной химиотерапии (одновременно или сразу после ее завершения), снижает относительный риск прогрессирования на ~ 50%. . При коротком периоде наблюдения это привело к умеренному, но статистически значимому улучшению общей выживаемости по сравнению с группой пациентов, получавших только адъювантную химиотерапию [ 49 , 50 ].
На основании этих клинических данных комбинации трастузумаба с химиотерапией были показаны пациентам с локализованными и диссеминированными опухолями молочной железы с гиперэкспрессией HER-2. В то же время использование трастузумаба (монотерапия) в качестве лечения первой линии диссеминированного рака молочной железы позволяет контролировать рост опухоли только у одной трети пациентов. Хотя комбинированное лечение (трастузумаб плюс химиотерапия) приводит к значительному «увеличению» выживаемости, объективный эффект наблюдается гораздо менее чем у 100% пациентов и всегда «прекращается» (рано или поздно опухоль начинает прогрессировать). Использование трастузумаба в сочетании с адъювантной терапией уменьшает, но не устраняет рецидивы, что позволяет предположить наличие естественной или приобретенной лекарственной устойчивости (если не имеется опровергающих доказательств).
Наличие HER-2 может быть доказано и определено с помощью зарегистрированных диагностических тестов и имеет прогностическое значение. С момента регистрации трастузумаба было аксиомой, что его введению должно предшествовать подтверждение HER-2-положительности соответствующих опухолей с использованием иммуногистохимических (ИГХ) методов и / или флуоресцентных или хромогенных методов in situ.гибридизация (FISH или CISH). Критерии положительности были разработаны на основе лабораторных и ранних клинических исследований. Сверхэкспрессия, то есть резкое увеличение популяции специфических рецепторов, была «подтверждена» IHC, в то время как амплификация гена была подтверждена с использованием FISH или CISH. Специфические критерии для назначения трастузумаба включали сверхэкспрессию HER-2, оцененную как 3+ и подтвержденную полуколичественными тестами ИГХ (интенсивное окрашивание> 10% мембран опухолевых клеток). Если сверхэкспрессия оценивалась как 2+ в IHC, амплификация гена должна была быть подтверждена данными FISH или CISH. В FISH HER-2-положительность определялась как отношение количества копий гена, кодирующего HER-2, к количеству копий 17-й хромосомы и составляла> = 2. В отсутствие сигнала 17-й хромосомы Наличие четырех копий гена HER-2 оценивалось как HER-2-положительность. Если, согласно CISH,> 50% опухолевых клеток содержали более пяти копий кодирующего гена, опухоли считались HER-2-положительными. Случаи, оцененные как 1+ и 0 в тесте IHC, считались HER-2-отрицательными и не подвергались терапии трастузумабом. Тем не менее прогностическая ценность HER-2-положительности была низкой: объективный противоопухолевый эффект трастузумаба отмечен только у 35% пациентов, отобранных по этим критериям, тогда как у остальных 65% пациентов признаки клинического улучшения отсутствовали [ Случаи, оцененные как 1+ и 0 в тесте IHC, считались HER-2-отрицательными и не подвергались терапии трастузумабом. Тем не менее прогностическая ценность HER-2-положительности была низкой: объективный противоопухолевый эффект трастузумаба отмечен только у 35% пациентов, отобранных по этим критериям, тогда как у остальных 65% пациентов признаки клинического улучшения отсутствовали [ Случаи, оцененные как 1+ и 0 в тесте IHC, считались HER-2-отрицательными и не подвергались терапии трастузумабом. Тем не менее прогностическая ценность HER-2-положительности была низкой: объективный противоопухолевый эффект трастузумаба отмечен только у 35% пациентов, отобранных по этим критериям, тогда как у остальных 65% пациентов признаки клинического улучшения отсутствовали [46 ]. Кроме того, механизм ремиссии и продления жизни при лечении трастузумабом пациентов с гиперэкспрессией HER-2 (по данным IHC) оставался неясным, поскольку даже у таких пациентов большинство опухолевых клеток могут не иметь мишеней для трастузумаба на поверхности мембраны. Каков же механизм действия трастузумаба на опухолевые клетки и каковы критерии отбора пациентов для терапии трастузумабом?
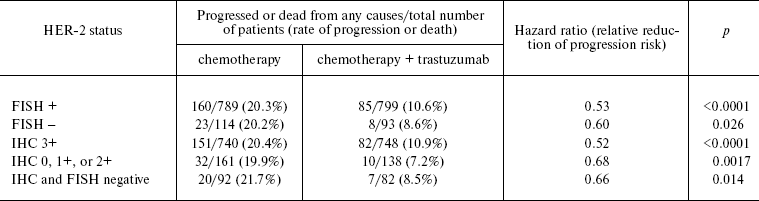
Эти вопросы все чаще поднимаются во многих недавних публикациях. Адъювантные испытания, предшествовавшие регистрации трастузумаба, использовали два подхода к оценке статуса HER-2. В двух испытаниях (NSABP B-31 и NCCTG N983) показание трастузумаба требовало сверхэкспрессии HER-2, оцениваемой как 3+ (IHC) и HER-2-положительной в FISH [ 50]. Подтверждение или опровержение сверхэкспрессии HER-2 (и / или амплификации гена) было сделано на основе результатов местных лабораторных тестов. Однако дальнейшие анализы потребовали их подтверждения и экспертной оценки центральной лабораторией. В активной фазе распределения пациентов по когортам частота ложноположительных результатов из местных лабораторий была очень высокой: ~ 20% случаев, оцененных местной лабораторией как HER-2-положительные, были оценены центральной лабораторией как отрицательные. Результаты исследования B-31, представленные группой NSABP [ 51] поставил под сомнение «ложную положительность» многих тестов на HER-2 в местных лабораториях. Таким образом, 207 из 1795 образцов FISH (11,5%), проанализированных в местной лаборатории, были признаны ложноположительными в центральной лаборатории, а 299 из 1787 образцов IHC (16,7%) были «отклонены». Более того, 174 из 1795 образцов (9,7%) оказались HER-2-отрицательными в обоих тестах. Совершенно неожиданно увеличение выживаемости от терапии трастузумабом у пациентов, опухоли которых были оценены центральной лабораторией как HER-2-отрицательные, было таким же, как и у пациентов, чей статус HER-2 был оценен как положительный в обеих лабораториях (Таблица 2 )!
Таблица 2. Снижение риска прогрессирования заболевания или смерти после назначения трастузумаба в зависимости от статуса HER-2 (данные центральной лаборатории) [ 51 ]
Какое значение эти открытия имеют для клинической практики? Во-первых, мы должны помнить, что у всех пациентов, включенных в исследования, были опухоли, оцененные как HER-2-положительные по результатам местных лабораторных исследований. Таким образом, ни один случай не может считаться никогда не признанным HER-2-положительным. Во-вторых, необходимо помнить, что граница положительности, используемая для клинических целей, в некоторой степени произвольна. Мы также не можем исключить возможность неравномерного распределения кластеров HER-2-положительных клеток в опухолях. Таким образом, возможно, что в местной лаборатории был проанализирован образец со сверхэкспрессией / амплификацией, в отличие от образца, проанализированного в центральной лаборатории. Несмотря на это,
Неизмеримо более важными являются «фундаментальные» проблемы, поднимаемые в этих исследованиях. Как влияние трастузумаба на очень небольшое количество клеток-мишеней (которые невозможно обнаружить даже методами ICH или FISH) приводит к изменению прогноза и общего течения болезни? Каковы цели действия трастузумаба и как это действие переводится в увеличение выживаемости (т. Е. Контроль над всей опухолью)? Может быть, очень небольшое количество опухолевых клеток, экспрессирующих HER-2 (не обнаруженных методами IHC и FISH), ухудшает прогноз из-за образования микрометастазов, а трастузумаб «корректирует» ситуацию на ранних стадиях заболевания? Однако тогда неясно, как все это согласуется с данными о корреляции между статусом HER-2 первичной опухоли и метастазами (в случае HER-2-отрицательных опухолей,
Отсутствие токсичности, связанной с основным механизмом действия трастузумаба, и низкий или нулевой уровень неспецифической токсичности. Подобно бевацизумабу, трастузумаб лишен токсичности, присущей классическим цитостатическим препаратам, но имеет ряд побочных эффектов. Его токсичность проявляется в подавлении сократимости миокарда, что сужает область применения и требует систематического мониторинга (например, эхокардиографии и др.), Направленного на раннюю диагностику осложнений и минимизацию риска фатальной токсичности [ 47 , 49 , 50]. Кардиотоксический эффект трастузумаба широко варьирует от клинически незначительных симптомов, выявленных при эхокардиографическом исследовании, до тяжелых, иногда фатальных, проявлений сердечной недостаточности. Частота этого осложнения зависит от многих факторов, таких как облучение левой половины грудной клетки в анамнезе, прием антрациклинов, ранее существовавшие сердечные патологии и т. Д. До 16% пациентов, получавших трастузумаб в качестве адъювантной терапии, были вынуждены отказаться от лечения из-за нарушений в самочувствии. сократимость миокарда; У 2% пациентов (0,4% в группе плацебо) развилась тяжелая сердечная недостаточность, несмотря на системный мониторинг. У пациентов с метастатическим раком молочной железы, получающих комбинированную терапию (трастузумаб плюс антрациклины), риск симптоматической




 Анализ гваякового кала на скрытую кровь (FOBT) проверяет наличие скрытой (скрытой) крови в стуле. Небольшие образцы стула помещаются на специальную карточку и возвращаются врачу или в лабораторию для анализа.
Анализ гваякового кала на скрытую кровь (FOBT) проверяет наличие скрытой (скрытой) крови в стуле. Небольшие образцы стула помещаются на специальную карточку и возвращаются врачу или в лабораторию для анализа. Иммунохимический анализ кала (FIT) проверяет наличие скрытой (скрытой) крови в стуле. Небольшой образец стула помещается в специальную пробирку или на специальные карточки и возвращается врачу или в лабораторию для анализа.
Иммунохимический анализ кала (FIT) проверяет наличие скрытой (скрытой) крови в стуле. Небольшой образец стула помещается в специальную пробирку или на специальные карточки и возвращается врачу или в лабораторию для анализа. Процедура бариевой клизмы. Пациент лежит на рентгеновском столе. Жидкий барий вводится в прямую кишку и проходит через толстую кишку. Рентген используется для поиска аномальных участков.
Процедура бариевой клизмы. Пациент лежит на рентгеновском столе. Жидкий барий вводится в прямую кишку и проходит через толстую кишку. Рентген используется для поиска аномальных участков. Сигмоидоскопия. Тонкая трубка с подсветкой вводится через задний проход и прямую кишку в нижнюю часть толстой кишки для поиска аномальных участков.
Сигмоидоскопия. Тонкая трубка с подсветкой вводится через задний проход и прямую кишку в нижнюю часть толстой кишки для поиска аномальных участков.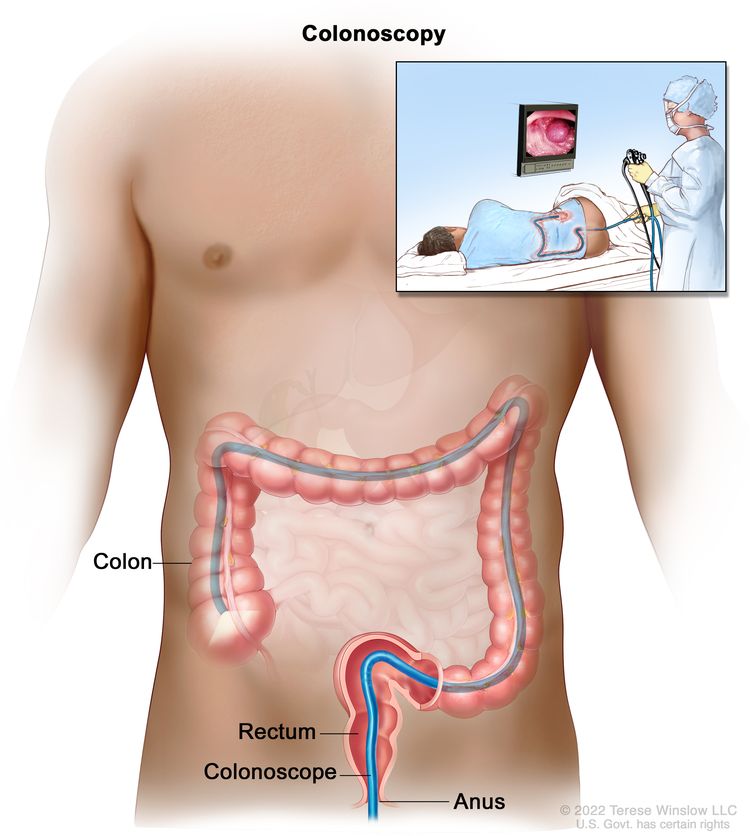 Колоноскопия. Тонкая трубка с подсветкой вводится через задний проход и прямую кишку в толстую кишку для поиска аномальных участков.
Колоноскопия. Тонкая трубка с подсветкой вводится через задний проход и прямую кишку в толстую кишку для поиска аномальных участков.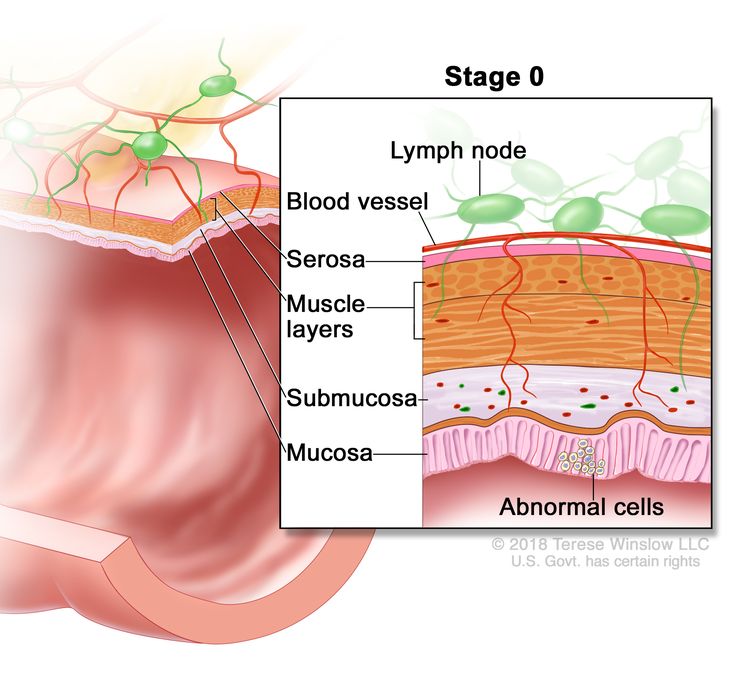 Стадия 0 (рак толстой кишки in situ). На слизистой оболочке стенки толстой кишки видны аномальные клетки.
Стадия 0 (рак толстой кишки in situ). На слизистой оболочке стенки толстой кишки видны аномальные клетки.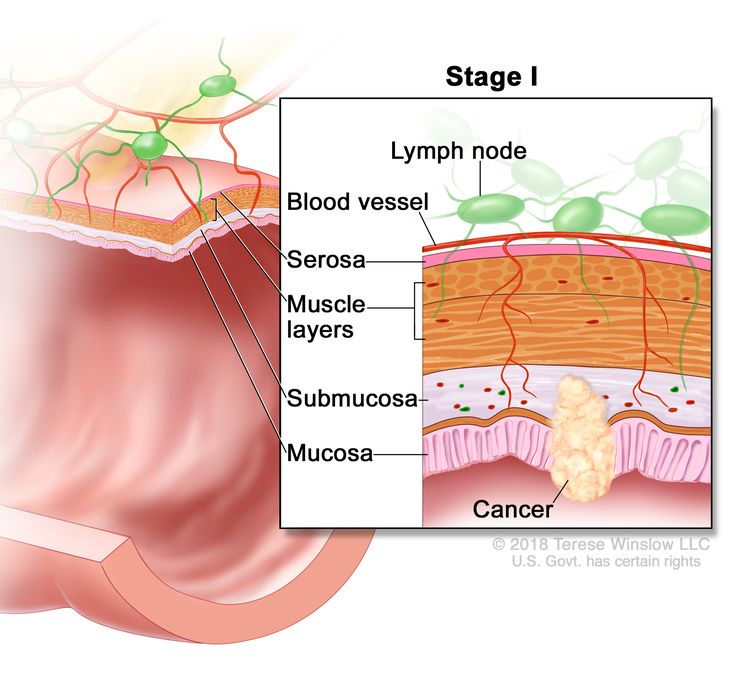 Рак толстой кишки I стадии. Рак распространился со слизистой стенки толстой кишки на подслизистую основу или мышечный слой.
Рак толстой кишки I стадии. Рак распространился со слизистой стенки толстой кишки на подслизистую основу или мышечный слой.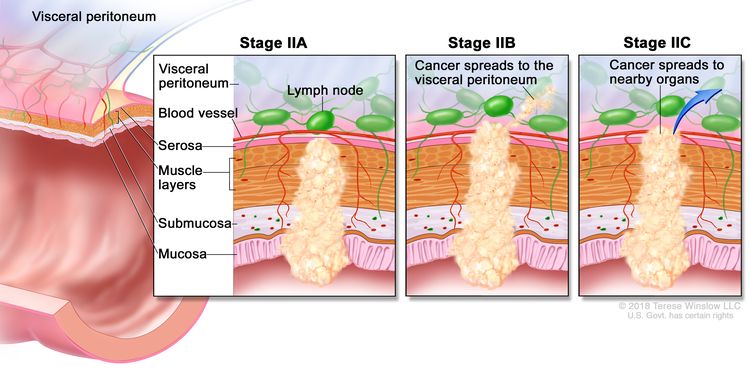 Рак толстой кишки II стадии. На стадии IIA рак распространился через мышечный слой стенки толстой кишки на серозную оболочку. На стадии IIB рак распространился через серозную оболочку, но не распространился на близлежащие органы. На стадии IIC рак распространился через серозную оболочку на близлежащие органы.
Рак толстой кишки II стадии. На стадии IIA рак распространился через мышечный слой стенки толстой кишки на серозную оболочку. На стадии IIB рак распространился через серозную оболочку, но не распространился на близлежащие органы. На стадии IIC рак распространился через серозную оболочку на близлежащие органы.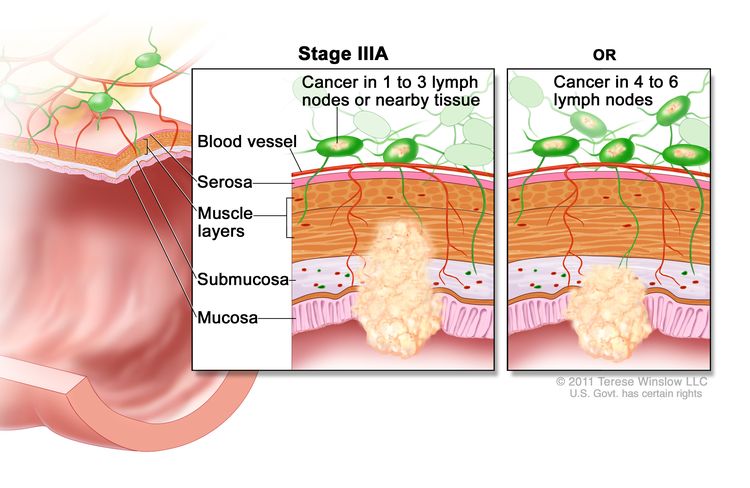 Рак толстой кишки IIIA стадии. Рак распространился через слизистую оболочку стенки толстой кишки на подслизистую основу и, возможно, распространился на мышечный слой и распространился на один-три соседних лимфатических узла или ткани рядом с лимфатическими узлами. ИЛИ, рак распространился через слизистую оболочку на подслизистую основу и от четырех до шести близлежащих лимфатических узлов.
Рак толстой кишки IIIA стадии. Рак распространился через слизистую оболочку стенки толстой кишки на подслизистую основу и, возможно, распространился на мышечный слой и распространился на один-три соседних лимфатических узла или ткани рядом с лимфатическими узлами. ИЛИ, рак распространился через слизистую оболочку на подслизистую основу и от четырех до шести близлежащих лимфатических узлов.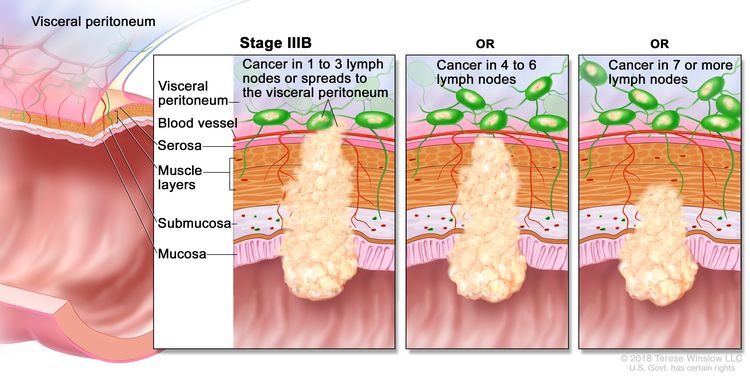 Рак толстой кишки IIIB стадии. Рак распространился через мышечный слой стенки толстой кишки на серозную оболочку или распространился через серозную оболочку, но не на близлежащие органы; рак распространился на один-три близлежащих лимфатических узла или на ткани, расположенные рядом с лимфатическими узлами. ИЛИ, рак распространился на мышечный слой или серозную оболочку, а также на четыре-шесть близлежащих лимфатических узлов. ИЛИ, рак распространился через слизистую на подслизистую и, возможно, на мышечный слой; рак распространился на семь или более близлежащих лимфатических узлов.
Рак толстой кишки IIIB стадии. Рак распространился через мышечный слой стенки толстой кишки на серозную оболочку или распространился через серозную оболочку, но не на близлежащие органы; рак распространился на один-три близлежащих лимфатических узла или на ткани, расположенные рядом с лимфатическими узлами. ИЛИ, рак распространился на мышечный слой или серозную оболочку, а также на четыре-шесть близлежащих лимфатических узлов. ИЛИ, рак распространился через слизистую на подслизистую и, возможно, на мышечный слой; рак распространился на семь или более близлежащих лимфатических узлов.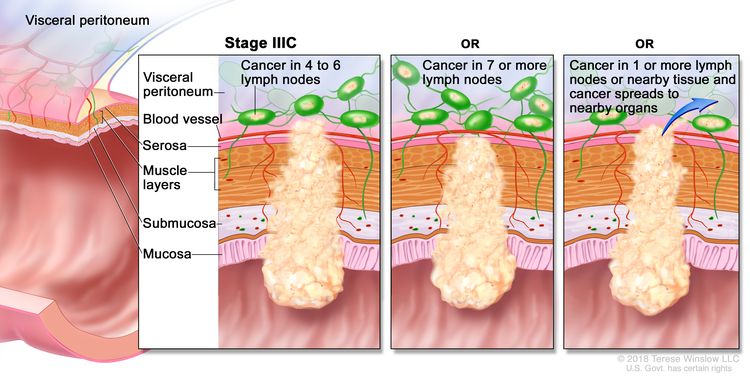 Рак толстой кишки IIIC стадии. Рак распространился через серозную оболочку стенки толстой кишки, но не на близлежащие органы; рак распространился на четыре-шесть близлежащих лимфатических узлов. ИЛИ, рак распространился через мышечный слой на серозную оболочку или распространился через серозную оболочку, но не на близлежащие органы; рак распространился на семь или более близлежащих лимфатических узлов. ИЛИ, рак распространился через серозную оболочку на близлежащие органы и на один или несколько близлежащих лимфатических узлов или на ткани рядом с лимфатическими узлами.
Рак толстой кишки IIIC стадии. Рак распространился через серозную оболочку стенки толстой кишки, но не на близлежащие органы; рак распространился на четыре-шесть близлежащих лимфатических узлов. ИЛИ, рак распространился через мышечный слой на серозную оболочку или распространился через серозную оболочку, но не на близлежащие органы; рак распространился на семь или более близлежащих лимфатических узлов. ИЛИ, рак распространился через серозную оболочку на близлежащие органы и на один или несколько близлежащих лимфатических узлов или на ткани рядом с лимфатическими узлами.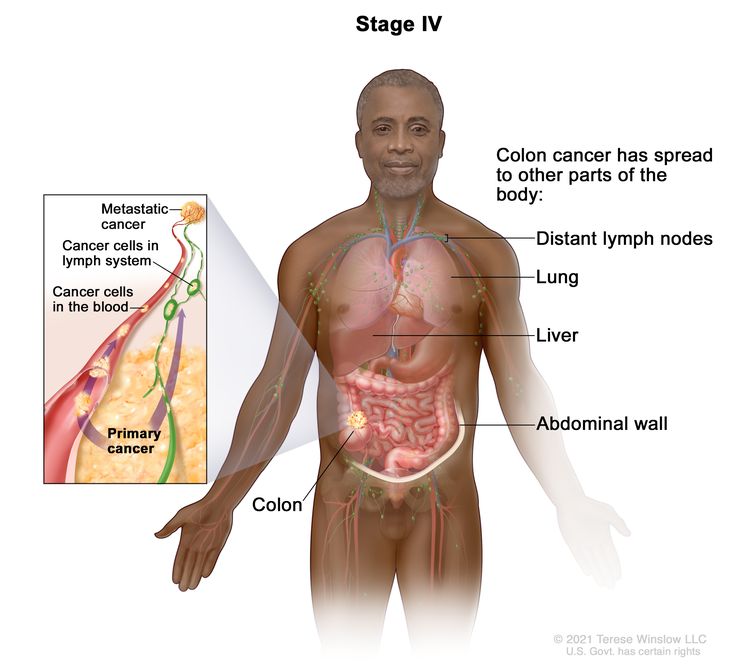 Рак толстой кишки IV стадии. Рак распространился через кровь и лимфатические узлы на другие части тела, такие как легкие, печень, брюшная стенка или яичник.
Рак толстой кишки IV стадии. Рак распространился через кровь и лимфатические узлы на другие части тела, такие как легкие, печень, брюшная стенка или яичник.