Рак толстой кишки: Лечение. Хирургия. Химиотерапия. Лучевая терапия. Иммунотерапия. Паллиативная помощь
Лечение колоректального рака может быть направлено на излечение или паллиативное лечение. Решение о том, какую цель принять, зависит от различных факторов, в том числе от состояния здоровья и предпочтений человека, а также от стадии опухоли. Когда колоректальный рак выявляется на ранней стадии, операция может быть излечивающей. Однако, когда это обнаруживается на более поздних стадиях (присутствуют метастазы ), это менее вероятно, и лечение часто направлено на паллиацию, чтобы облегчить симптомы, вызванные опухолью, и обеспечить человеку максимально комфортное состояние.
Хирургия
 Схема локальной резекции рака толстой кишки на ранней стадии
Схема локальной резекции рака толстой кишки на ранней стадии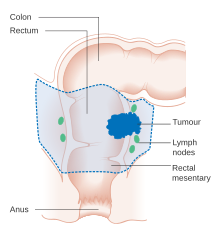 Схема местной хирургии при раке прямой кишки
Схема местной хирургии при раке прямой кишки
Если рак обнаружен на очень ранней стадии, он может быть удален во время колоноскопии с использованием различных методов, включая EMR и ESD . Для людей с локализованным раком предпочтительным лечением является полное хирургическое удаление с адекватными краями с попыткой достижения излечения. Выбранная процедура - это частичная колэктомия (или проктоколэктомия при повреждениях прямой кишки), при которой пораженная часть толстой кишки или прямой кишки удаляется вместе с частями ее мезоколона и кровоснабжения для облегчения удаления дренирующих лимфатических узлов . Это может быть сделано с помощью открытой лапаротомии или лапароскопически в зависимости от пациента и факторов поражения.
Если в печени или легких имеется только несколько метастазов, их также можно удалить.
Иногда химиотерапия используется перед операцией, чтобы уменьшить рак, прежде чем пытаться удалить его. Двумя наиболее распространенными местами рецидива колоректального рака являются печень и легкие.
Химиотерапия
Как в случае рака толстой кишки , так и прямой кишки химиотерапия может быть использована в дополнение к хирургическому вмешательству в некоторых случаях. Решение включить химиотерапию при лечении рака толстой кишки и прямой кишки зависит от стадии заболевания.
На стадии I рака толстой кишки химиотерапия не предлагается, и хирургическое вмешательство является окончательным лечением. Роль химиотерапии при раке толстой кишки II стадии является дискуссионной и обычно не предлагается, если не определены факторы риска, такие как опухоль Т4, недифференцированная опухоль, сосудистая и периневральная инвазия или неадекватный отбор проб лимфатических узлов. Также известно, что люди, которые несут аномалии генов восстановления несоответствия, не извлекают выгоду из химиотерапии. Для рака толстой кишки стадии III и стадии IV химиотерапия является неотъемлемой частью лечения.
Если рак распространился на лимфатические узлы или отдаленные органы, что имеет место в случае рака толстой кишки стадии III и стадии IV соответственно, добавление химиотерапевтических агентов фторурацил , капецитабин или оксалиплатин увеличивает продолжительность жизни. Если лимфатические узлы не содержат рак, преимущества химиотерапии спорны. Если рак широко метастатический или неоперабельный, лечение является паллиативным . Как правило, в этом случае может использоваться ряд различных химиотерапевтических препаратов. Химиотерапевтические препараты для этого состояния могут включать капецитабин , фторурацил , иринотекан , оксалиплатини UFT . Препараты капецитабин и фторурацил являются взаимозаменяемыми, причем капецитабин является пероральным препаратом, а фторурацил - препаратом для внутривенного введения. Некоторые конкретные схемы, используемые для CRC: CAPOX , FOLFOX , FOLFOXIRI и FOLFIRI. Антиангиогенные препараты, такие как бевацизумаб , часто добавляют в терапию первой линии. Другим классом лекарств, используемых во второй линии, являются ингибиторы рецептора эпидермального фактора роста , из которых два одобренных FDA - цетуксимаб и панитумумаб .
Основным отличием в подходе к раку прямой кишки низкой стадии является включение лучевой терапии. Часто он используется в сочетании с химиотерапией неоадъювантным способом для проведения хирургической резекции, так что в конечном итоге колостомия не требуется. Тем не менее, это может быть невозможно при низколежащих опухолях, и в этом случае может потребоваться постоянная колостома. Рак прямой кишки стадии IV лечится аналогично раку толстой кишки стадии IV.
Лучевая терапия
Хотя комбинация лучевой и химиотерапии может быть полезна при раке прямой кишки, ее использование при раке толстой кишки не является обязательным из-за чувствительности кишечника к облучению. Как и в случае химиотерапии , лучевая терапия может использоваться в неоадъювантной и адъювантной обстановке для некоторых стадий рака прямой кишки. Для местно-распространенного рака прямой кишки неоадъювантная химиолучевая терапия стала стандартным лечением.
Иммунотерапия
Было обнаружено, что иммунотерапия ингибиторами иммунной контрольной точки полезна при типе колоректального рака с дефицитом несоответствия восстановления и нестабильностью микросателлитов. Пембролизумаб одобрен для прогрессирующих опухолей CRC, которые имеют дефицит MMR и не прошли обычное лечение. Другие виды колоректального рака по состоянию на 2017 год все еще изучаются.
Паллиативная помощь
Паллиативная помощь рекомендуется для любого человека, у которого имеется прогрессирующий рак толстой кишки или у которого имеются значительные симптомы.
Вовлечение паллиативной помощи может быть полезным для улучшения качества жизни как человека, так и его или ее семьи, путем улучшения симптомов, тревоги и предотвращения госпитализации.
У людей с неизлечимым колоректальным раком паллиативная помощь может состоять из процедур, которые снимают симптомы или осложнения от рака, но не пытаются вылечить основной рак, тем самым улучшая качество жизни . Хирургические варианты могут включать не лечащее хирургическое удаление части раковой ткани, обход части кишечника или размещение стента. Можно считать, что эти процедуры улучшают симптомы и уменьшают такие осложнения, как кровотечение из опухоли, боль в животе и кишечную непроходимость. Неоперативные методы симптоматического лечения включают лучевую терапию для уменьшения размера опухоли, а также обезболивающие препараты.
 Схема локальной резекции рака толстой кишки на ранней стадии
Схема локальной резекции рака толстой кишки на ранней стадии Схема местной хирургии при раке прямой кишки
Схема местной хирургии при раке прямой кишки