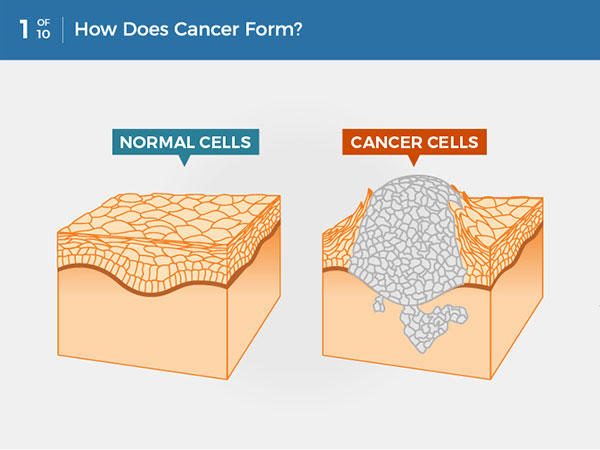
Некроз обладает провоспалительным и опухолевым потенциалом
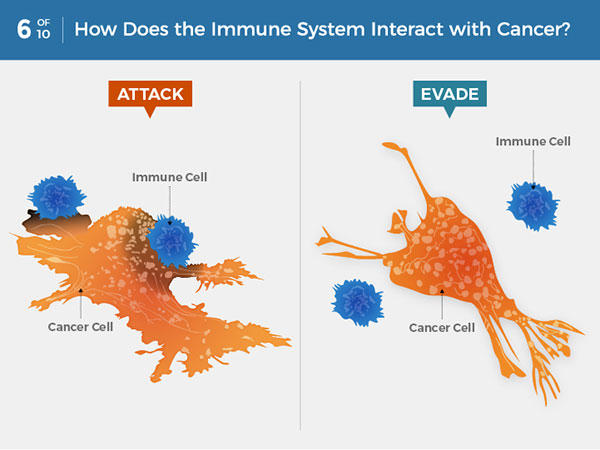
В отличие от апоптоза, при котором умирающая клетка сжимается в почти невидимый труп, который вскоре съедается соседями, некротические клетки раздуваются и взрываются, высвобождая свое содержимое в местное тканевое микроокружение. Хотя некроз исторически рассматривался во многом как гибель организма, как форма общесистемного истощения и разрушения, концептуальный ландшафт меняется: смерть клеток в результате некроза явно находится под генетическим контролем в некоторых обстоятельствах, а не является случайным и ненаправленным процессом (Галлуцци и Кремер, 2008 г., Зонг и Томпсон, 2006 г.).Возможно, более важно то, что некротическая гибель клеток высвобождает провоспалительные сигналы в микроокружение окружающей ткани, в отличие от апоптоза и аутофагии, которые этого не делают. Как следствие, некротические клетки могут привлекать воспалительные клетки иммунной системы (Гривенников и др., 2010, White et al., 2010, Галлуцци и Кремер, 2008 г.), чья специальная функция заключается в изучении степени повреждения тканей и удалении связанных с ними некротических остатков. Однако в контексте неоплазии многочисленные доказательства указывают на то, что иммунные воспалительные клетки могут активно способствовать развитию опухоли, учитывая, что такие клетки способны стимулировать ангиогенез, пролиферацию раковых клеток и инвазивность (см. Ниже). Кроме того, некротические клетки могут высвобождать биоактивные регуляторные факторы, такие как IL-1α, которые могут напрямую стимулировать пролиферацию соседних жизнеспособных клеток с потенциалом, опять же, для облегчения опухолевой прогрессии (Гривенников и др., 2010). Следовательно, некротическая гибель клеток, хотя и полезна для уравновешивания гиперпролиферации, связанной с раком, в конечном итоге может принести больше вреда, чем пользы. Соответственно, зарождающиеся новообразования и потенциально инвазивные и метастатические опухоли могут получить преимущество, выдерживая некоторую степень некротической гибели клеток, делая это для привлечения стимулирующих опухоль воспалительных клеток, которые приносят факторы, стимулирующие рост, к выжившим клеткам в этих наростах.
Включение репликативного бессмертия
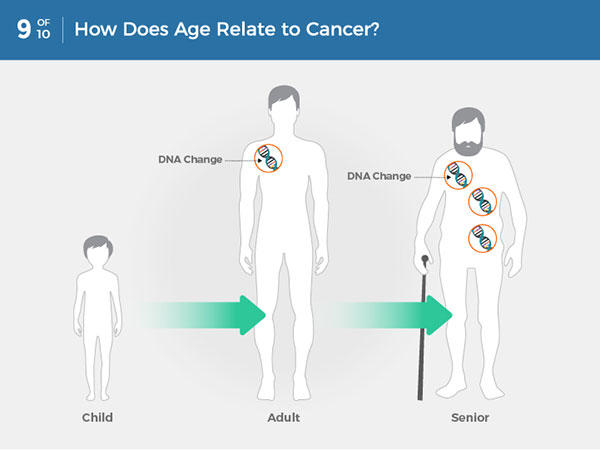
К 2000 году было широко признано, что раковые клетки требуют неограниченного репликативного потенциала для образования макроскопических опухолей. Эта способность резко контрастирует с поведением клеток в большинстве нормальных клеточных линий в организме, которые способны пройти лишь ограниченное количество последовательных циклов роста и деления клеток. Это ограничение было связано с двумя различными препятствиями для пролиферации: старением, обычно необратимым переходом в непролиферативное, но жизнеспособное состояние, и кризисом, который включает гибель клеток. Соответственно, когда клетки размножаются в культуре, повторяющиеся циклы деления клеток приводят сначала к индукции старения, а затем, для тех клеток, которым удается преодолеть этот барьер, к кризисной фазе, в которой подавляющее большинство клеток в популяции погибает. В редких случаях клетки появляются из популяции, находящейся в кризисе, и демонстрируют неограниченный репликативный потенциал. Этот переход был назван иммортализацией - чертой, которой обладают большинство установленных клеточных линий в силу их способности размножаться в культуре без признаков старения или кризиса.Многочисленные доказательства указывают на то, что теломеры, защищающие концы хромосом, принимают центральное участие в способности к неограниченному размножению (Бласко, 2005 г., Шэй и Райт, 2000). Теломеры, состоящие из множества тандемных гексануклеотидных повторов, постепенно укорачиваются в неиммортализованных клетках, размножающихся в культуре, в конечном итоге теряя способность защищать концы хромосомной ДНК от слияния конца в конец; такие слияния генерируют нестабильные дицентрические хромосомы, разрешение которых приводит к искажению кариотипа, что угрожает жизнеспособности клеток. Соответственно, длина теломерной ДНК в клетке диктует, сколько последовательных поколений клеток может пройти ее потомство, прежде чем теломеры в значительной степени разрушатся и, следовательно, потеряют свои защитные функции, вызывая вход в кризис.Теломераза, специализированная ДНК-полимераза, которая добавляет сегменты теломер-повторов к концам теломерной ДНК, почти отсутствует в неиммортализованных клетках, но экспрессируется на функционально значимых уровнях в подавляющем большинстве (~ 90%) спонтанно иммортализованных клеток, включая раковые клетки человека. Расширяя теломерную ДНК, теломераза способна противодействовать прогрессирующей эрозии теломер, которая в противном случае произошла бы в ее отсутствие. Наличие активности теломеразы либо в спонтанно иммортализованных клетках, либо в контексте клеток, сконструированных для экспрессии фермента, коррелирует с устойчивостью к индукции как старения, так и кризиса / апоптоза; Напротив, подавление активности теломеразы приводит к укорачиванию теломер и к активации одного или другого из этих пролиферативных барьеров.Два барьера для распространения - старение и кризис / апоптоз - были рационализированы как решающие противораковые защиты, которые жестко встроены в наши клетки и используются для предотвращения роста клонов предопухолевых и откровенно неопластических клеток. Согласно этому мнению, большинство зарождающихся новообразований исчерпывают свой запас репликативных удвоений и останавливаются на своем пути одним или другим из этих барьеров. Возможная иммортализация редких вариантных клеток, которые продолжают формировать опухоли, объясняется их способностью поддерживать теломерные ДНК на длинах, достаточных, чтобы избежать запуска старения или апоптоза, что чаще всего достигается за счет повышения экспрессии теломеразы или, реже, за счет альтернативной рекомбинации - основанный на механизме поддержания теломер. Следовательно,
Переоценка репликативного старения
В то время как поддержание теломер все больше и больше обосновывается как условие, критическое для неопластического состояния, концепция индуцированного репликацией старения как общего барьера требует уточнения и переформулирования. (Различия в структуре и функции теломер в клетках мыши и человека также усложнили исследование роли теломер и теломеразы в репликативном старении.) Недавние эксперименты показали, что индукция старения в некоторых культивируемых клетках может быть отсрочена и, возможно, устранена путем использования улучшенных условий культивирования клеток, предполагая, что недавно эксплантированные первичные клетки могут быть способны беспрепятственно размножаться в культуре до критической точки и связанной с этим индукции апоптоза, вызванного критически укороченными теломерами (Ince et al., 2007, Пассос и др., 2007, Чжан и др., 2004 г., Шерр и ДеПиньо, 2000 г.). Напротив, эксперименты на мышах, у которых отсутствует теломераза, показывают, что вследствие этого укороченные теломеры могут шунтировать предраковые клетки в стареющее состояние, которое способствует (наряду с апоптозом) ослабленному онкогенезу у мышей, генетически предназначенных для развития определенных форм рака (Артанди и ДеПиньо, 2010 г.). Такие нулевые по теломеразе мыши с сильно эродированными теломерами демонстрируют полиорганную дисфункцию и аномалии, которые включают свидетельства как старения, так и апоптоза, возможно, аналогичные старению и апоптозу, наблюдаемым в культуре клеток (Артанди и ДеПиньо, 2010 г., Фельдсер и Грейдер, 2007 г.).Следует отметить, и как обсуждалось ранее, морфологически сходная форма клеточного старения, индуцированная избыточной или несбалансированной передачей сигналов онкогенов, теперь хорошо документирована как защитный механизм против неоплазии; возможные взаимосвязи этой формы старения с теломеразой и теломерами еще предстоит выяснить. Таким образом, клеточное старение концептуально возникает как защитный барьер для опухолевой экспансии, который может быть запущен различными аномалиями, связанными с пролиферацией, включая высокие уровни онкогенной передачи сигналов и, по-видимому, субкритическое укорочение теломер.
Отсроченная активация теломеразы может как ограничивать, так и способствовать неопластическому прогрессированию
В настоящее время имеются данные о том, что клоны зарождающихся раковых клеток часто испытывают кризис, вызванный потерей теломер, относительно рано в ходе многоступенчатого прогрессирования опухоли из-за их неспособности экспрессировать значительные уровни теломеразы. Таким образом, широко разрушенные теломеры были задокументированы в предраковых образованиях с помощью флуоресцентной гибридизации in situ (FISH), которая также выявила сквозные хромосомные слияния, которые сигнализируют о повреждении и кризисе теломер (Каваи и др., 2007 г., Hansel et al., 2006). Эти результаты также предполагают, что такие клетки прошли через значительное количество последовательных клеточных делений, укорачивающих теломер, во время своей эволюции из полностью нормальных исходных клеток. Соответственно, развитие некоторых неоплазий человека может быть прервано теломерным кризисом задолго до того, как они превратятся в макроскопические, откровенно неопластические образования.Напротив, отсутствие TP53-опосредованного надзора за целостностью генома может позволить другим зарождающимся новообразованиям пережить начальную эрозию теломер и сопутствующие циклы разрыва-слияния хромосом (BFB). Геномные изменения, возникающие в результате этих циклов БОС, включая делеции и амплификации хромосомных сегментов, очевидно, служат для увеличения изменчивости генома, тем самым ускоряя приобретение мутантных онкогенов и генов-супрессоров опухолей. Осознание того, что нарушение функции теломер может фактически способствовать прогрессированию опухоли, пришло из исследования мутантных мышей, у которых отсутствует функция р53 и теломеразы (Артанди и ДеПиньо, 2010 г., Артанди и ДеПиньо, 2000 г.). Предположение о том, что эти два дефекта могут совместно усиливать онкогенез человека, еще не подтверждено документально.Косвенное подтверждение важности преходящего дефицита теломер для облегчения злокачественного прогрессирования получено, кроме того, сравнительным анализом предраковых и злокачественных поражений в груди человека (Рейно и др., 2010 г., Чин и др., 2004 г.). Предраковые поражения не выражали значительных уровней теломеразы и были отмечены укорочением теломер и неклональными хромосомными аберрациями. Напротив, явные карциномы проявляют экспрессию теломеразы одновременно с реконструкцией более длинных теломер и фиксацией (посредством клонального разрастания) аберрантных кариотипов, которые, по-видимому, были приобретены после отказа теломер, но до приобретения теломеразной активности. Когда это изображено таким образом, отсроченное приобретение функции теломеразы служит для генерации опухолевых мутаций, тогда как его последующая активация стабилизирует мутантный геном и придает неограниченную репликативную способность, которая требуется раковым клеткам для образования клинически очевидных опухолей.
Новые функции теломеразы
Теломераза была открыта из-за ее способности удлинять и поддерживать теломерную ДНК, и почти все исследования теломеразы основывались на представлении о том, что ее функции ограничиваются этой важной функцией. Однако в последние годы стало очевидно, что теломераза выполняет функции, относящиеся к пролиферации клеток, но не связанные с поддержанием теломер. Неканонические роли теломеразы и, в частности, ее белковой субъединицы TERT, были выявлены функциональными исследованиями на мышах и культивируемых клетках; в некоторых случаях новые функции были продемонстрированы в условиях, когда ферментативная активность теломеразы была устранена (Конг и Шей, 2008). Среди растущего списка теломер-независимых функций TERT / теломеразы - способность TERT усиливать передачу сигналов по пути Wnt, выступая в качестве кофактора комплекса факторов транскрипции β-катенин / LEF (Парк и др., 2009 г.). Другие приписываемые теломер-независимые эффекты включают очевидное усиление пролиферации клеток и / или устойчивости к апоптозу (Канг и др., 2004 г.), участие в репарации повреждений ДНК (Масутоми и др., 2005 г.) и РНК-зависимая функция РНК-полимеразы (Майда и др., 2009 г.). В соответствии с этими более широкими ролями, TERT может быть обнаружен связанным с хроматином во многих участках хромосом, а не только в теломерах (Парк и др., 2009 г., Масутоми и др., 2005 г.). Следовательно, поддержание теломер оказывается наиболее важной из множества различных функций, в выполнении которых участвует TERT. Вклад этих дополнительных функций теломеразы в туморогенез еще предстоит полностью выяснить.
Индуцирование ангиогенеза
Как и нормальные ткани, опухоли требуют поддержки в виде питательных веществ и кислорода, а также способности выводить метаболические отходы и углекислый газ. Связанная с опухолью новая сосудистая сеть, созданная в процессе ангиогенеза, удовлетворяет эти потребности. Во время эмбриогенеза развитие сосудистой сети включает рождение новых эндотелиальных клеток и их сборку в трубочки (васкулогенез) в дополнение к прорастанию (ангиогенез) новых сосудов из существующих. После этого морфогенеза нормальная сосудистая сеть в значительной степени становится неподвижной. У взрослых, как часть физиологических процессов, таких как заживление ран и репродуктивный цикл женщин, ангиогенез включается, но только временно. Напротив, во время прогрессирования опухоли «ангиогенный переключатель» почти всегда активируется и остается включенным,Ханахан и Фолкман, 1996 г.).Неоспоримая совокупность доказательств указывает на то, что ангиогенное переключение регулируется уравновешивающими факторами, которые либо индуцируют, либо препятствуют ангиогенезу (Бэрисвил и Кристофори, 2009 г., Бергерс и Бенджамин, 2003 г.). Некоторые из этих ангиогенных регуляторов представляют собой сигнальные белки, которые связываются со стимулирующими или ингибирующими рецепторами клеточной поверхности, отображаемыми эндотелиальными клетками сосудов. Хорошо известными прототипами индукторов и ингибиторов ангиогенеза являются фактор роста эндотелия сосудов-A (VEGF-A) и тромбоспондин-1 (TSP-1) соответственно.Ген VEGF-A кодирует лиганды, которые участвуют в организации роста новых кровеносных сосудов во время эмбрионального и постнатального развития, а затем в гомеостатическом выживании эндотелиальных клеток, а также в физиологических и патологических ситуациях у взрослых. Передача сигналов VEGF через три рецепторных тирозинкиназы (VEGFR-1–3) регулируется на нескольких уровнях, что отражает сложность цели. Таким образом, экспрессия гена VEGF может повышаться как за счет гипоксии, так и за счет передачи сигналов онкогенов (Феррара, 2009 г., Мак Габанн и Попел, 2008 г., Кармелье, 2005 г.). Кроме того, лиганды VEGF могут быть изолированы во внеклеточном матриксе в латентных формах, которые подвергаются высвобождению и активации протеазами, разрушающими внеклеточный матрикс (например, MMP-9;Kessenbrock et al., 2010). Кроме того, другие проангиогенные сигналы, такие как члены семейства факторов роста фибробластов (FGF), участвуют в поддержании ангиогенеза опухоли, когда их экспрессия постоянно повышается (Бэрисвил и Кристофори, 2009 г.). TSP-1, ключевой противовес в ангиогенном переключателе, также связывает трансмембранные рецепторы, отображаемые эндотелиальными клетками, и тем самым вызывает подавляющие сигналы, которые могут противодействовать проангиогенным стимулам (Казерунян и др., 2008 г.).Кровеносные сосуды, образующиеся в опухолях в результате хронически активированного ангиогенеза и несбалансированного сочетания проангиогенных сигналов, обычно аберрантны: новая сосудистая сеть опухоли характеризуется преждевременным разрастанием капилляров, извилистым и чрезмерным разветвлением сосудов, деформированными и расширенными сосудами, неравномерным кровотоком, микрогеморрагированием, неплотностью и аномальные уровни пролиферации эндотелиальных клеток и апоптоза (Надь и др., 2010 г., Балук и др., 2005).Ангиогенез индуцируется неожиданно рано во время многоступенчатого развития инвазивного рака как в моделях на животных, так и у людей. Гистологические анализы предраковых неинвазивных поражений, включая дисплазии и карциномы in situ, возникающие в различных органах, выявили раннее срабатывание ангиогенного переключателя (Райка и др., 2009 г., Ханахан и Фолкман, 1996 г.). Исторически считалось, что ангиогенез важен только тогда, когда сформировались быстрорастущие макроскопические опухоли, но более свежие данные показывают, что ангиогенез также вносит вклад в микроскопическую предраковую фазу неопластического прогрессирования, еще больше укрепляя его статус как неотъемлемого признака рака.Последнее десятилетие засвидетельствовано поразительным ростом исследований ангиогенеза. Среди этого богатства новых знаний мы выделяем несколько достижений, имеющих особое отношение к физиологии опухолей.
Градации ангиогенного переключателя
После активации ангиогенеза опухоли демонстрируют различные модели неоваскуляризации. Некоторые опухоли, в том числе такие высокоагрессивные, как аденокарциномы протоков поджелудочной железы, гиповаскуляризированы и изобилуют стромальными «пустынями», которые в основном бессосудистые и даже могут быть активно антиангиогенными (Олив и др., 2009 г.). Многие другие опухоли, в том числе нейроэндокринные карциномы почек и поджелудочной железы человека, имеют высокую ангиогенность и, следовательно, имеют плотную васкуляризацию (Зи и др., 2010 г., Тернер и др., 2003 г.).В совокупности такие наблюдения предполагают начальное срабатывание ангиогенного переключателя во время развития опухоли, за которым следует переменная интенсивность продолжающейся неоваскуляризации, последняя контролируется сложным биологическим реостатом, который включает как раковые клетки, так и связанную с ними стромальную микросреду (Бэрисвил и Кристофори, 2009 г., Бергерс и Бенджамин, 2003 г.). Следует отметить, что механизм переключения может различаться по своей форме, даже если конечным результатом является обычный индуктивный сигнал (например, VEGF). В некоторых опухолях доминирующие онкогены, действующие в опухолевых клетках, такие как Ras и Myc , могут повышать экспрессию ангиогенных факторов, тогда как в других такие индуктивные сигналы косвенно продуцируются иммунными воспалительными клетками, как обсуждается ниже. Прямая индукция ангиогенеза онкогенами, которые также управляют пролиферативной передачей сигналов, иллюстрирует важный принцип, согласно которому различные возможности отличительных признаков могут регулироваться одними и теми же трансформирующими агентами.
Ингибиторы эндогенного ангиогенеза представляют собой естественные барьеры для ангиогенеза опухоли
Исследования 1990-х годов показали, что TSP-1, а также фрагменты плазмина (ангиостатин) и коллагена 18 типа (эндостатин) могут действовать как эндогенные ингибиторы ангиогенеза (Рибатти, 2009 г., Казерунян и др., 2008 г., Фолкмен, 2006, Фолькмен, 2002, Нюберг и др., 2005 г.). За последнее десятилетие были зарегистрированы сообщения еще об одном десятке таких агентов (Рибатти, 2009 г., Фолкмен, 2006, Нюберг и др., 2005 г.). Большинство из них являются белками, и многие из них получены протеолитическим расщеплением структурных белков, которые сами по себе не являются ангиогенными регуляторами. Ряд этих эндогенных ингибиторов ангиогенеза можно обнаружить в кровообращении у нормальных мышей и людей. Гены, кодирующие несколько эндогенных ингибиторов ангиогенеза, были удалены из зародышевой линии мыши без неблагоприятных физиологических эффектов; однако рост автохтонных и имплантированных опухолей, как следствие, усиливается (Рибатти, 2009 г., Нюберг и др., 2005 г.). Напротив, если циркулирующие уровни эндогенного ингибитора генетически увеличены (например, за счет сверхэкспрессии у трансгенных мышей или в ксенотрансплантированных опухолях), рост опухоли нарушается (Рибатти, 2009 г., Нюберг и др., 2005 г.); Интересно, что заживление ран и отложение жира ухудшаются или ускоряются из-за повышенной или пониженной экспрессии таких генов (Цао, 2010 г., Сеппинен и др., 2008 г.). Данные предполагают, что такие эндогенные ингибиторы ангиогенеза в нормальных условиях служат физиологическими регуляторами, которые модулируют переходный ангиогенез во время ремоделирования ткани и заживления ран; они также могут действовать как внутренние барьеры для индукции и / или сохранения ангиогенеза за счет зарождающихся новообразований.
Перициты - важные компоненты неоваскулярной сети опухоли
Перициты давно известны как поддерживающие клетки, которые тесно прилегают к внешним поверхностям эндотелиальных трубок в сосудистой сети нормальной ткани, где они обеспечивают важную механическую и физиологическую поддержку эндотелиальным клеткам. В отличие от этого, сосудистая сеть, связанная с опухолью, не имела заметного покрытия этими вспомогательными клетками. Однако тщательные микроскопические исследования, проведенные в последние годы, показали, что перициты связаны, хотя и слабо, с новой сосудистой сетью большинства, если не всех опухолей (Раза и др., 2010 г., Бергерс и Сонг, 2005). Что еще более важно, механистические исследования, обсуждаемые ниже, показали, что покрытие перицитами важно для поддержания функциональной новой сосудистой сети опухоли.
Разнообразные клетки костного мозга способствуют ангиогенезу опухоли
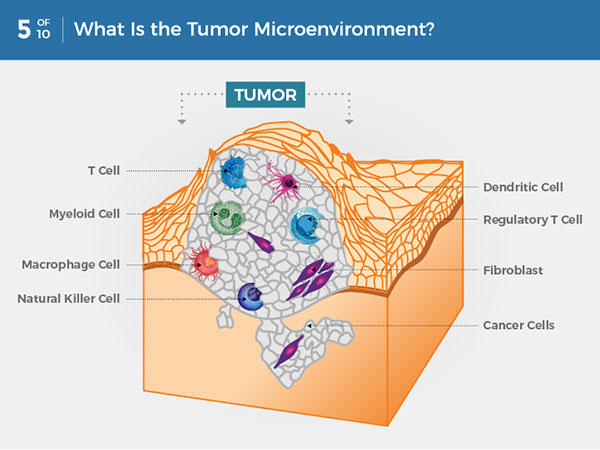
Теперь ясно, что набор типов клеток, происходящих из костного мозга, играет решающую роль в патологическом ангиогенезе (Цянь и Поллард, 2010 г., Зумстег и Христофори, 2009 г., Мердок и др., 2008 г., Де Пальма и др., 2007 г.). К ним относятся клетки врожденной иммунной системы - особенно макрофаги, нейтрофилы, тучные клетки и миелоидные предшественники - которые инфильтрируют предраковые поражения и прогрессирующие опухоли и собираются на краях таких поражений; периопухолевые воспалительные клетки помогают отключать ангиогенный переключатель в ранее покоящейся ткани и поддерживать продолжающийся ангиогенез, связанный с ростом опухоли, в дополнение к облегчению местной инвазии, как указано ниже. Кроме того, они могут помочь защитить сосудистую сеть от воздействия лекарств, нацеленных на передачу сигналов эндотелиальных клеток (Феррара, 2010 г.). Кроме того, в некоторых случаях наблюдалось, что несколько типов «сосудистых клеток-предшественников» костного мозга мигрировали в неопластические поражения и интеркалировались в неоваскулярную сеть в виде перицитов или эндотелиальных клеток (Патенауд и др., 2010 г., Ковачич и Бем, 2009 г., Ламанья и Бергерс, 2006 г.).
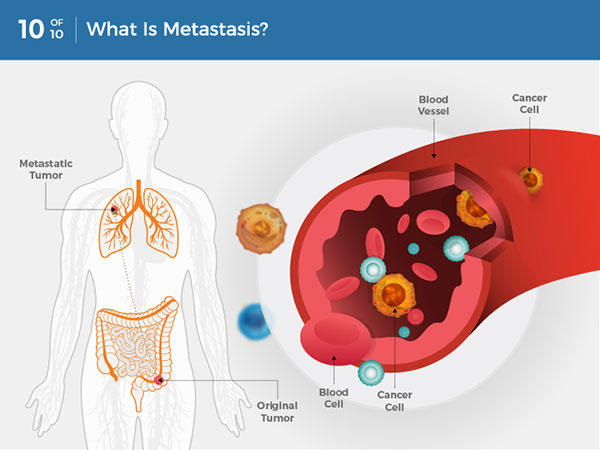
Активация вторжения и метастазирования
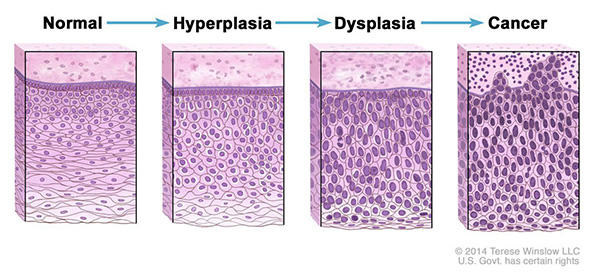
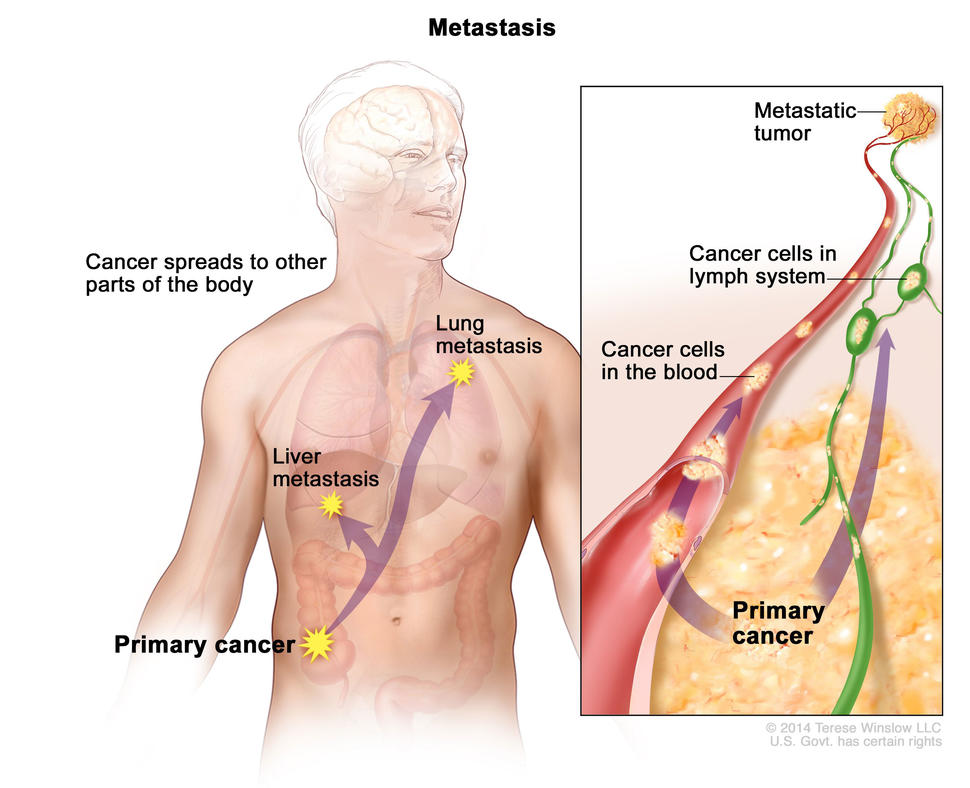
В 2000 году механизмы, лежащие в основе инвазии и метастазирования, в значительной степени оставались загадкой. Было ясно, что по мере того, как карциномы, возникающие из эпителиальных тканей, прогрессируют до более высоких патологических степеней злокачественности, что отражается в местной инвазии и отдаленных метастазах, связанные раковые клетки обычно изменяют свою форму, а также их прикрепление к другим клеткам и внеклеточному матриксу. (ECM). Наиболее хорошо охарактеризованное изменение связано с потерей клетками карциномы E-кадгерина, ключевой молекулы межклеточной адгезии. Образуя адгезивные соединения с соседними эпителиальными клетками, E-кадгерин помогает собирать листы эпителиальных клеток и поддерживать покой клеток в этих слоях. Повышенная экспрессия E-кадгерина была хорошо известна как антагонист инвазии и метастазирования. тогда как известно, что снижение его экспрессии усиливает эти фенотипы. Часто наблюдаемое подавление и случайная мутационная инактивация E-кадгерина в карциномах человека убедительно подтверждают его роль в качестве ключевого супрессора этой отличительной способности (Берк и ван Рой, 2009 год, Кавалларо и Кристофори, 2004 г.).Кроме того, экспрессия генов, кодирующих другие молекулы адгезии межклеточная и межклеточная адгезия, явно изменена в некоторых высокоагрессивных карциномах, причем те, которые способствуют цитостазу, обычно подавляются. Напротив, молекулы адгезии, обычно связанные с миграциями клеток, которые происходят во время эмбриогенеза и воспаления, часто активируются. Например, N-кадгерин, который обычно экспрессируется в мигрирующих нейронах и мезенхимальных клетках во время органогенеза, активируется во многих клетках инвазивной карциномы. Помимо получения и потери таких прикрепляющих белков клетка-клетка / матрикс, главные регуляторы инвазии и метастазирования были в значительной степени неизвестны или, при подозрении, не имели функциональной проверки (Кавалларо и Кристофори, 2004 г.).Многоступенчатый процесс инвазии и метастазирования был схематизирован как последовательность дискретных шагов, часто называемых каскадом инвазии и метастазирования (Талмадж и Фидлер, 2010 г., Фидлер, 2003 г.). Это изображение представляет собой последовательность клеточно-биологических изменений, начиная с местной инвазии, затем - интравазационного проникновения раковых клеток в близлежащие кровеносные и лимфатические сосуды, прохождения раковых клеток через лимфатическую и гематогенную системы с последующим выходом раковых клеток из просвета таких сосудов. сосудов в паренхиму отдаленных тканей (экстравазация), образование небольших узелков раковых клеток (микрометастазов) и, наконец, рост микрометастатических поражений в макроскопические опухоли, этот последний этап называется «колонизацией».Исследования способности к инвазии и метастазированию резко ускорились за последнее десятилетие, поскольку стали доступны новые мощные исследовательские инструменты и усовершенствованные экспериментальные модели, а также были определены важнейшие регуляторные гены. Несмотря на то, что это все еще развивающаяся область, изобилующая основными вопросами, на которые нет ответов, был достигнут значительный прогресс в определении важных характеристик этой сложной отличительной черты. Предположительно неполное представление об этих достижениях освещается ниже.
Программа ЕМТ широко регулирует вторжение и метастазирование
Программа регуляции развития, называемая «эпителиально-мезенхимальный переход» (EMT), стала широко использоваться как средство, с помощью которого трансформированные эпителиальные клетки могут приобретать способность вторгаться, противостоять апоптозу и распространять (Климковский и Савагнер, 2009 г., Поляк и Вайнберг, 2009 г., Тиери и др., 2009 г., Йылмаз и Христофори, 2009 г., Барралло-Гимено и Ньето, 2005 г.). Кооптируя процесс, вовлеченный в различные стадии эмбрионального морфогенеза и заживления ран, клетки карциномы могут одновременно приобретать несколько атрибутов, которые делают возможной инвазию и метастазирование. Эта многогранная программа EMT может быть активирована временно или стабильно и в разной степени клетками карциномы в ходе инвазии и метастазирования.Набор плейотропно действующих транскрипционных факторов, включая Snail, Slug, Twist и Zeb1 / 2, управляет EMT и родственными миграционными процессами во время эмбриогенеза; большинство из них были первоначально идентифицированы генетикой развития. Эти регуляторы транскрипции экспрессируются в различных комбинациях в ряде типов злокачественных опухолей и, как было показано на экспериментальных моделях образования карциномы, имеют причинное значение для программирования инвазии; некоторые из них вызывают метастазы при эктопической сверхэкспрессии (Микалицци и др., 2010 г., Таубе и др., 2010 г., Schmalhofer et al., 2009 г., Ян и Вайнберг, 2008 г.). В числе клеток-биологические черт , вызванные такими факторами транскрипции являются потери слипчивых соединений и связанное с ними преобразованием из полигональной в / эпителиальной к веретенообразной / фибробластической морфологии, экспрессия разрушающих матрикс ферментов, увеличению подвижности и повышенной устойчивости к апоптозу всех признакам вовлечены в процессы инвазии и метастазирования. Некоторые из этих факторов транскрипции могут напрямую подавлять экспрессию гена E-кадгерина, тем самым лишая неопластические эпителиальные клетки этого ключевого супрессора подвижности и инвазивности (Пейнадо и др., 2004 г.).Имеющиеся данные свидетельствуют о том, что эти факторы транскрипции регулируют друг друга, а также перекрывающиеся наборы генов-мишеней. Еще не установлены правила для описания их взаимодействия и условий, регулирующих их выражение. Данные генетики развития показывают, что контекстные сигналы, полученные от соседних клеток эмбриона, участвуют в запуске экспрессии этих факторов транскрипции в тех клетках, которые должны пройти через EMT (Микалицци и др., 2010 г.); Аналогичным образом, все больше данных свидетельствует о том, что гетеротипические взаимодействия раковых клеток с соседними ассоциированными с опухолью стромальными клетками могут индуцировать экспрессию фенотипов злокачественных клеток, которые, как известно, регулируются одним или несколькими из этих регуляторов транскрипции (Карнуб и Вайнберг, 2006–2007 гг., Brabletz et al., 2001). Более того, можно видеть, что раковые клетки на инвазивных краях некоторых карцином подверглись EMT, что позволяет предположить, что эти раковые клетки подвергаются стимулам микросреды, отличным от тех, которые получают раковые клетки, расположенные в сердцевинах этих поражений (Hlubek et al., 2007).Хотя доказательства все еще неполны, похоже, что факторы транскрипции, индуцирующие ЕМТ, способны управлять большинством шагов каскада инвазии-метастазирования, за исключением последнего шага колонизации. Мы все еще довольно мало знаем о различных проявлениях и временной стабильности мезенхимального состояния, вызванного ЭМП. Хотя экспрессия факторов транскрипции, индуцирующих ЕМТ, наблюдалась в некоторых типах неэпителиальных опухолей, таких как саркомы и нейроэктодермальные опухоли, их роль в программировании злокачественных признаков в этих опухолях в настоящее время плохо документирована. Кроме того, еще предстоит определить, обязательно ли клетки инвазивной карциномы приобретают свою способность через активацию частей программы EMT, или альтернативные регуляторные программы также могут активировать эту способность.
Гетеротипический вклад стромальных клеток в инвазию и метастазирование
Становится все более очевидным, что перекрестные помехи между раковыми клетками и клетками неопластической стромы участвуют в приобретенной способности к инвазивному росту и метастазированию (Эгеблад и др., 2010 г., Цянь и Поллард, 2010 г., Джойс и Поллард, 2009 г., Каллури и Зейсберг, 2006 г.). Такая передача сигналов может воздействовать на клетки карциномы и действовать, чтобы изменить их отличительные возможности, как было предложено выше. Например, было обнаружено, что мезенхимальные стволовые клетки (МСК), присутствующие в строме опухоли, секретируют CCL5 / RANTES в ответ на сигналы, испускаемые раковыми клетками; CCL5 затем действует реципрокно на раковые клетки, стимулируя инвазивное поведение (Карноуб и др., 2007 г.).Макрофаги на периферии опухоли могут способствовать местной инвазии, поставляя разрушающие матрикс ферменты, такие как металлопротеиназы и протеазы цистеин-катепсина (Kessenbrock et al., 2010, Джойс и Поллард, 2009 г., Палермо и Джойс, 2008 г., Мохамед и Слоан, 2006 г.); в одной модельной системе макрофаги, способствующие инвазии, активируются IL-4, продуцируемым раковыми клетками (Гочева и др., 2010). И в экспериментальной модели метастатического рака молочной железы ассоциированные с опухолью макрофаги (ТАМ) поставляют эпидермальный фактор роста (EGF) в клетки рака молочной железы, в то время как раковые клетки взаимно стимулируют макрофаги с помощью CSF-1; их согласованное взаимодействие способствует проникновению в кровеносную систему и метастатическому распространению раковых клеток (Цянь и Поллард, 2010 г., Wyckoff et al., 2007).Подобные наблюдения показывают, что фенотипы злокачественных новообразований высокой степени не возникают строго клеточно-автономным образом, и что их проявление нельзя понять только с помощью анализа геномов опухолевых клеток. Одним из важных выводов, все еще не проверенных, является то, что способность преодолевать большинство этапов каскада инвазии-метастазирования может быть приобретена в определенных опухолях без требования, чтобы связанные раковые клетки претерпевали дополнительные мутации помимо тех, которые были необходимы для образования первичной опухоли.
 УВЕЛИЧИТЬ
УВЕЛИЧИТЬ


 УВЕЛИЧИТЬ
УВЕЛИЧИТЬ